Rhodium, Rh, je přechodný prvek patřící mezi platinové kovy. Stejně jako ostatní platinové kovy je poměrně nereaktivní, odolný vůči korozi a má vysokou teplotu tání. Využívá se jako přísada do slitin s platinou, které se využívají v termočláncích (např. pro TG/DSC). Objeven byl roku 1803 angličanem Williamem Hyde Wollastonem.
| Atomové číslo | 45 | Počet stabilních izotopů | 1 |
| Atomová hmotnost | 102,90550 | Elektronová konfigurace | [Kr] 4d8 5s1 |
| Teplota tání [°C] | 1964 | Teplota varu [°C] | 3695 |
| Elektronegativita | 2,28 | Hustota [g.cm-3] | 12,41 |
Izotopy
Rhodium má jediný stabilní izotop, 103Rh. Charakterizováno bylo 33 radioizotopů, nejdelší poločas přeměny má 101Rh, 3,3 roku.
Výskyt
V přírodě se nachází převážně ryzí, společně s dalšími drahými kovy.

Chemické vlastnosti
Nejběžnější oxidační stav pro rhodium je +III, ale tvoří sloučeniny ve všech stavech od 0 do +VI. Za červeného žáru pozvolna reaguje s kyslíkem a halogeny. Je odolné vůči kyselinám, i lučavce královské. Kovové rhodium lze převést do roztoku mineralizací s NaHSO4, čímž získáme rozpustný síran rhoditý Rh2(SO4)3. Ten lze připravit i reakcí s koncentrovanou kyselinou sírovou, ale až po 80 hodinách za teploty 400 °C v zatavené ampuli.[7]
Nejdůležitější sloučeninou rhodia je zřejmě Wilkinsonův katalyzátor – RhCl(PPh3)3 – chlorid tris(trifenylfosfan)rhodný. Ten se využívá při hydrogenaci propylenu.
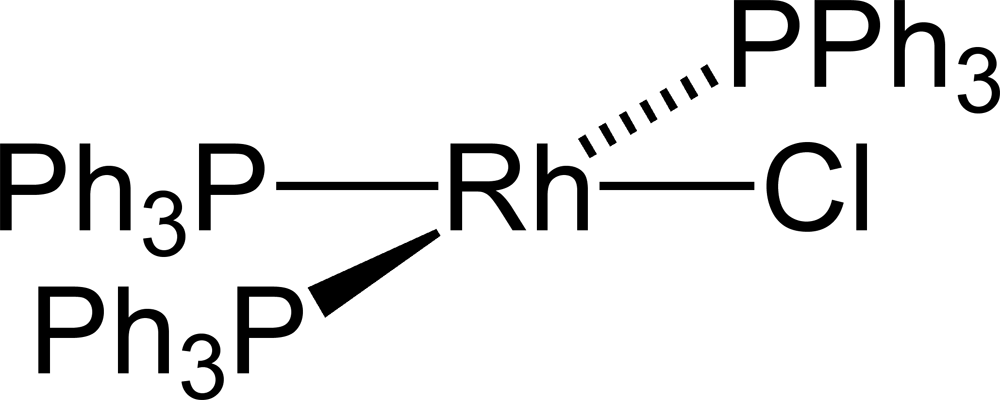
NMR
Rhodium je monoizotopické, jeho jediný přírodní izotop má spin ½ a v NMR vykazuje velmi široké rozpětí chemických posunů. Využívá se pro studium komplexů rhodia a jejich dynamických rovnováh. Pro interpretaci spekter je důležité i štěpení od jiných jader, např. 1H, 13C, 31P, 35Cl, … Standardem je roztok acetylacetonátu rhoditého Rh(acac)3.
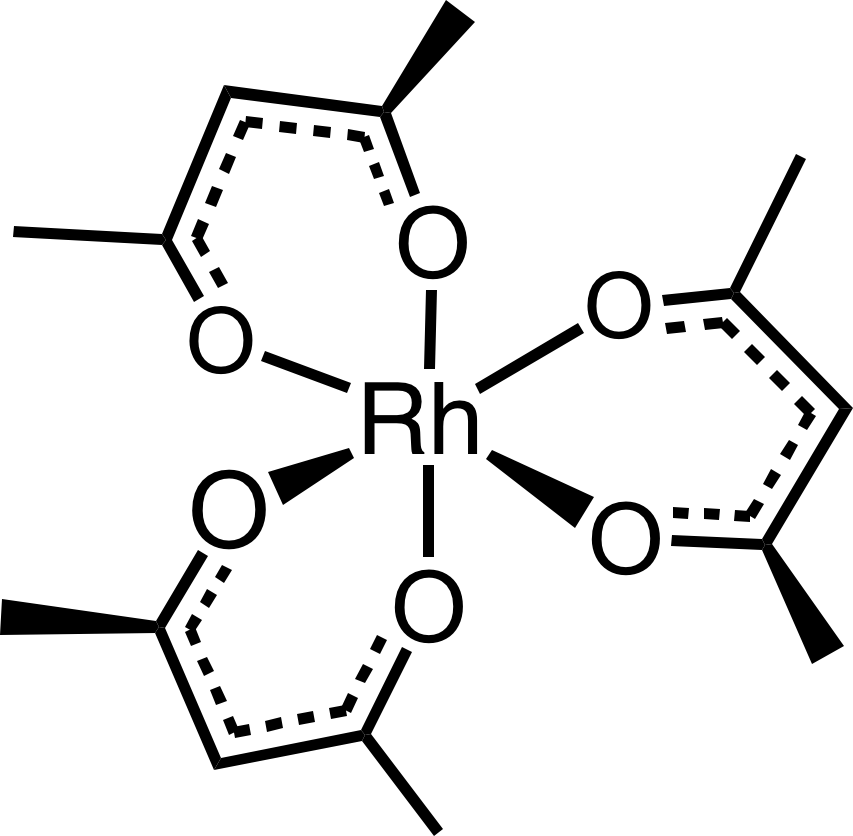
| 103Rh | |
| Spin | 1/2 |
| Zastoupení v přírodě [%] | 100 |
| Rezonanční frekvence v poli 1 T | 1,3477 |
| Rozsah chemických posunů | -2100 – 11 000 |
| Jaderný magnetický moment | -0,08840 |
| Citlivost vůči 1H | 3,17.10-5 |
| Citlivost vůči 13C | 0,186 |
Odkazy
- Rhodium na české wikipedii
- Rhodium na anglické wikipedii
- 103Rh NMR
- Ernsting, J.M.; Gaemers, S.; Elsevier, C.J. Magn. Res. Chem. 2004, 42, 721-736. 103Rh NMR spectroscopy and its application to rhodium chemistry.
- Geswindt, T.E.; Gerber, W.J.; Brand, D.J.; Koch, K.R. Anal. chim. Acta 2012, 730, 93-98. 35Cl/37Cl isotope effects in 103Rh NMR of [RhCln(H2O)6−n]3−n complex anions in hydrochloric acid solution as a unique ‘NMR finger-print’ for unambiguous speciation
- Rhodium roles
- Oxidizing Rhodium with Sulfuric Acid: The Sulfates Rh2(SO4)3 and Rh2(SO4)3·2H2O
Navigace
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| H | He | ||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr |
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe |
| Cs | Ba | La | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| Fr | Ra | Ac | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |
| Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu |
| Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr |
One Reply to “Rhodium”