Selen byl objeven roku 1817 Jacobem Berzeliem a Johanem Gottliebem Gahnem. Je to kovový prvek s důležitými fotoelektickými vlastnostmi. Tvoří několik alotropických modifikací. Získává se ze zbytků po spalování síry nebo po zpracování sirných rud. V přírodě se vyskytuje v nízkých koncentracích v sirných rudách.
| Atomové číslo | 34 | Počet stabilních izotopů | 6 |
|---|---|---|---|
| Atomová hmotnost | 78,96 | Elektronová konfigurace | [Ar] 3d10 4s2 4p4 |
| Teplota tání [°C] | 217 | Teplota varu [°C] | 685 |
| Hustota | 4,19-4,39 |
Využití
Hlavní využití selenu je ve sklářském průmyslu, kde se využívá k potlačení zeleného odstínu skla způsobeného železem a v tabulovém skle pro snížení propustnosti tepla. Důležitá je jeho fotovodivost, díky které nachází významné využití v xerografii, tzn. hlavně v kopírkách a laserových tiskárnách. Amorfní selen se využívá jako polovodivá vrstva na otočném válci. Během kopírování se tato vrstva nabije vysokým napětím a pak je na ni promítán obraz, který se má kopírovat. Na neosvětlených místech válce se náboj udrží, na osvětlených nikoliv. V druhém kroku je na válec nanesen práškový toner, který přilne pouze k nabitým místům a poté se přenese na papír, do kterého se zapeče. Válec se pak vybije a je připraven na další kopii. Dále nacházíme amorfní selen v polovodičových detektorech pro RTG zařízení, zejména v lékařství.
Alotropie
Selen se vyskytuje v několika alotropních formách.
Termodynamicky nejstabilnějším alotropem je šedý selen, který je tvořen paralelními šroubovicemi. Má kovové vlastnosti a vykazuje fotovodivost.
Krystalický, červený selen je tvořen molekulami Se8, které jsou analogické cyklooktasíře. Tvoří tři modifikace
- α-Se8 vzniká pomalým odpařením roztoku černého selenu v CS2.
- β-Se8 vzniká rychlým odpařením roztoku černého selenu v CS2.
- γ-Se8 vzniká solvolýzou roztoku dipiperidinotetraselenu v CS2:
- 8 Se4(NC5H10)2 + 16 CS2 → 3 Se8 + 8 Se(S2CNC5H10)2
Červený amorfní selen vzniká kondenzací par selenu.
Černý selen je tvořen polymerními kruhy.

Chemické vlastnosti
Selen tvoří sloučeniny v oxidačních číslech -II, II, IV a VI.
Hydridy
Selan, SeH2, je bezbarvý, hořlavý a toxický plyn. Vzniká hydrolýzou selenidů, nebo reakcí z prvků:
Al2Se3 + 6 H2O → 3 H2Se + 2 Al(OH)3
FeSe + 2 HCl → H2Se + FeCl2
Se + H2 → H2Se
Vytváří vodné roztoky, které jsou kyselejší než roztoky sulfanu.
Selenidy
Selenidy jsou binární sloučeniny selenu s dalším kovem, selen zde vyskytuje jako anion Se2-. Můžeme je považovat za soli kyseliny selenovodíkové (SeH2).
Selenidy alkalických kovů a kovů alkalických zemin se připravují přímou reakcí z prvků za zvýšené teploty a nepřítomnosti vzduchu. Příp. se získávají z roztoků kovů v kapalném amoniaku.
Oxidy a kyseliny
Reakcí s kyslíkem vzniká oxid seleničitý (SeO2), který je velmi toxický a s vodou reaguje za vzniku kyseliny seleničité (H2SeO3). Používá se jako oxidační činidlo v organické syntéze.[4] Oxid selenový (SeO3) je termodynamicky nestabilní a při teplotách nad 185 °C se rozkládá. Připravuje se reakcí bezvodého selenanu draselného s oxidu sírového.[5]
2 SeO3 → 2 SeO2 + O2
K2SeO4 + SO3 → K2SO4 + SeO3
Kyselinu selenovou (H2SeO4) lze připravit oxidací oxidu seleničitého peroxidem vodíku.
SeO2 + H2O2 → H2SeO4
Podobně jako kyselina sírová, je velmi dobře rozpustná ve vodě a jde o silnou kyselinu. Je silnější oxidační činidlo než kyselina sírová. Do prvního stupně je disociovaná zcela, pKa druhého stupně je 1,92. Při teplotách nad 200 °C se rozkládá na kyselinu seleničitou a kyslík.
Kyselina seleničitá (H2SeO3) vzniká rozpouštěním oxidu seleničitého ve vodě, využívá se v organické syntéze pro přípravu 1,2-diketonů.[6] Používá se také na tzv. studené černění oceli, které se provádí roztokem síranu měďnatého s kyselinou seleničitou v ethanolu.
Nitridy
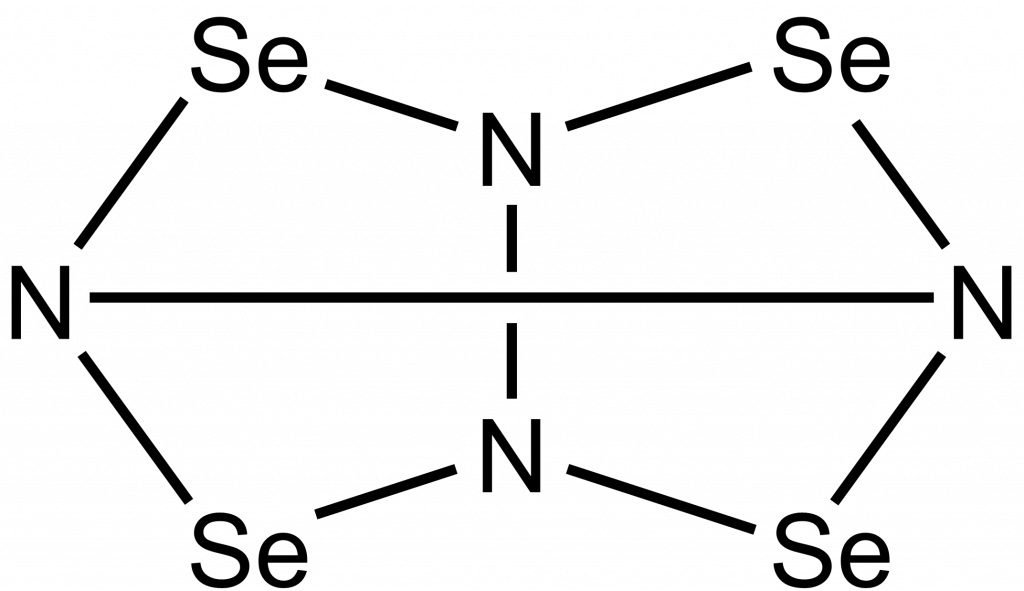
Tetranitrid tetraselenu, Se4N4, je oranžová látka, která velmi ochotně exploduje, jako inciace stačí náraz nebo zahřátí. Připravuje se reakcí chloridu seleničitého s bis(trimethylsilyl)amidem lithným.[8]
12 (Me3Si)2NLi + 2 Se2Cl2 + 8 SeCl4 → 3 Se4N4 + 24 Me3SiCl + 12 LiCl
Je termochromní, tzn. že s teplotou se mění jeho barva. Při teplotě -195 °C je žlutooranžový, po zahřátí na 100 °C se jeho barva mění na červenou.
NMR
V NMR se využívá pouze izotop 77Se, který má spin 1/2 a zastoupení přes 7,5 %. Jeho citlivost je nízká, poskytuje úzké linie v širokém rozsahu chemických posunů. Standardem je dimethylselan Me2Se. Jako vhodnější standard se jeví selenany, např. selenan sodný – Na2SeO4.[9]
| 77Se | |
|---|---|
| Spin | 1/2 |
| Zastoupení v přírodě [%] | 7,63 |
| Citlivost vzhledem k 1H | 5,37.10-4 |
| Citlivost vzhledem k 13C | 3,15 |
| Rezonanční frekvence v poli 1 T | 8,1571 |
| Rozsah chemických posunů | -1000 až +2000 ppm |
| Jaderný magnetický moment | +0,53506 |
Chemické posuny
| Se4+ | 1900-900 | H2SeO3 | 1300 |
| Se6+ | 800-600 | Sulfidy selenu | 750-250 |
| Diarylselenany | 600-300 | Alkyl-arylselenany | 400-250 |
| Dialkyldiselenany | 500-200 | R2SeCl2 | 600-500 |
| Se=CX2 | 700-200 | Me2P=Se | 240 |
| RSeH | 270-(-320) | R3Se+ | 370-220 |
Odkazy
- Selen na české wikipedii
- Selen na anglické wikipedii
- 77Se NMR
- Oxidation with Selenium Dioxide
- Selenium trioxide
- Glyoxal bisulfite
- Elemental Se: fundamentals and its optoelectronic applications
- A simple, efficient synthesis of tetraselenium tetranitride
- Selenate—An internal chemical shift standard for aqueous 77Se NMR spectroscopy
Navigace
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| H | He | ||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr |
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe |
| Cs | Ba | La | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| Fr | Ra | Ac | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |
| Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu |
| Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr |
3 Replies to “Selen”