Tyto látky obsahují ve své struktuře centra vykazující silnou Lewisovskou kyselost, díky čemuž byly studovány jako potenciální katalyzátory polymeračních reakcí cyklických esterů, během kterých dochází k otevírání kruhu.Další důležitou oblastí, ve které mohou chloridy-alkoxidy hlinité nalézt praktické využití je příprava aluminy a materiálů založených na oxidu hlinitém. Díky přítomnosti chloridové a alkylové skupiny mohou tyto látky snadno podléhat eliminacím alkylchloridů a následné kondenzaci za vzniku vazebného motivu Al–O–Al. Tato transformace může proběhnout termicky, v plynné fázi (CVD) nebo v roztoku během sol-gelových procesů.
Sloučeniny tohoto typu byly připravovány reakcí chloridu hlinitého s vhodným alkoxidem hlinitým výměnou ligandů. První strukturně charakterizovaný chlorid-alkoxid hlinitý měl trojjadernou strukturu. Centrální spiroatom měl koordinační číslo pět, zbylé dva atomy hliníku byly koordinovány tetraedricky.
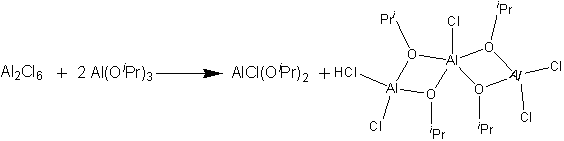
V roztoku chloridy-alkoxidy hlinité tvoří směs různých oligomerních forem. Mezi těmito oligomery dochází k neustálé redistribuci ligandů za vzniku neutrálních i iontových komplexů.Z těchto roztoků lze krystalizací izolovat vícejaderné sloučeniny.
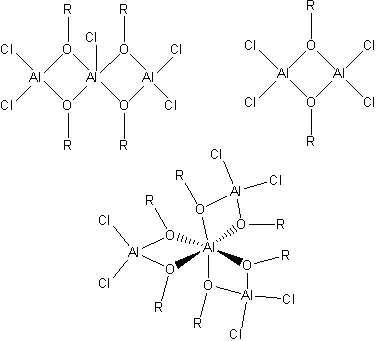
Obr. 1 Ukázky vybraných struktur chloridů-alkoxidů hlinitých
Reakce chloridů-alkoxidů hlinitých s alkoholy
V roce 2003 byla publikována studie reakcí MeAlCl2 s alifatickými alkoholy. V závislosti na použitém alkoholu byly v reakční směsi pozorovány produkty redistribuce ligandů [Cl2Al(μ-OR)2]2AlCl a/nebo [Cl2Al(μ-OR)2]3Al a také dimerní nebo trimerní chlorid-alkoxid [ROAlCl2]n, (n = 2, 3).
Z publikovaných výsledků plyne, že alkoxidy odvozené od primárních alkoholů s dlouhým, lineárním řetězcem preferují tří- a čtyřjaderné komplexy. V případě sekundárních alkoholů (iPr, sBu), příp. primárních s rozvětveným β-uhlíkem jsou preferovány tříjaderné komplexy. tBuOAlCl2 připravený z terciárního alkoholu neposkytnul oligomerní sloučeninu, ale pomalu se za laboratorní teploty rozkládal.
Stupeň asociace studovaných alkoxidů ROAlCl2 je závislý na sterických nárocích alkoxidové skupiny. Rovnováha dimer-trimer byla pozorována u alkoxidů odvozených od primárních alkoholů. Dimerní formu preferovaly alkoxidy odvozené od sekundárních a terciárních alkoholů, příp. od primárních alkoholů s rozvětvením na β-uhlíku.
V roce 2007 byla publikována jiná metoda přípravy těchto chloridů-alkoxidů hlinitých. Autoři použili jako výchozí látky Al(OEt)3 a Me2AlCl nebo EtAlBr2. Získali a strukturně charakterizovali dva nové molekulární halogenidy-alkoxidy hlinité, jejichž struktura odpovídá struktuře Mitsubishi alkoxidu.
Příprava trimerní cyklické sloučeniny [Al3Cl6(CH3O)3] byla publikována v roce 1999. Byla připravena reakcí dichlormethylalanu s methanolem v n-pentanu za laboratorní teploty. Průměrné hodnoty úhlů O–Al–O a Cl–Al–Cl v molekule byly 98,5 resp. 114,9 °, což odpovídalo deformovanému tetraedrickému uspořádání atomu hliníku. Délky vazeb Al–Cl (průměrně 2,096 Å) odpovídaly typickým hodnotám pro tetraedricky koordinovaný hliník. Délky vazeb Al–O byly menší než u dříve popsané sloučeniny [Me2AlOMe]3, což bylo způsobeno přítomností elektronegativnějšího substituentu (Cl) na atomech hliníku.
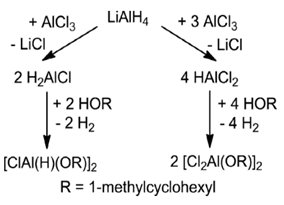
Reakce LiAlH4 s AlCl3 a alkoholy
Reakce tetrahydridohlinitanu lithného s chloridem hlinitým v poměru 1:3 poskytly monomerní dichloralan s dvěmi koordinovanými molekulami N-methylpiperidinu. Taková struktura nebyla dosud v literatuře popsána. Díky koordinaci dvou molekul báze, získala molekula bodovou grupu symetrie C2v. Hliníkový atom vykazoval koordinační číslo pět v deformované trigonální bipyramidě. Atomy dusíky byly v axiálních polohách, zatímco atomy chloru a vodík obsadily ekvatoriální polohy.
LiAlH4 + 3 AlCl2 + 8 C6H11N → 4[HAlCl2•2C6H11N] + LiCl
Reakcí tohoto produktu s 2,4-ditertbutyl-4-methylfenolem byl získán monomerní dichlorid-alkoxid hlinitý koordinovaný jednou molekulou báze. Reakce s cyklohexanolem poskytla tříjaderný spirocyklický produkt, centrální atom hliníku získal koordinační číslo šest, zatímco terminální si zachovaly koordinační číslo čtyři.
[HAlCl2•2C6H11N] + ROH → [Cl2Al(OR)•2C6H11N]
R = 2,4-tBu-4-MeC6H2
[HAlCl2•2C6H11N] + ROH → [(Cl2Al)3(μ-OR)4][H(C6H11N)2].Et2O
R = cHex
Dvoustupňovou reakcí podle schématu na obrázku 2 byly získány dva produkty v závislosti na stechiometrických poměrech reaktantů. Prvním produktem byl čtyřčlenný cyklus, jehož oba atomy hliníku získaly koordinační číslo čtyři a nesou tři rozdílné substituenty (H, Cl, OR). Tato látka vykazovala v 27Al NMR spektru dva signály (89 a 100 ppm), které byly přiřazeny izomerům cis a trans. Druhý produkt má podobnou strukturu, atomy hliníku nesou tentokrát dva rozdílné substituenty (Cl a OR). Délky vazeb Al–O jsou u obou látek téměř shodné, přibližně 1,80 Å.
Obr. 2 Schéma dvoustupňové reakce
Transformace alkylalanů hlinitých na oxid hlinitý
Jednoduchou metodou přípravy oxidu hlinitého z příslušných alkylalanů je hydrolýza. Příkladem může být metoda publikovaná v roce 2010, využívající hydrolýzy trimethylalanu (TMA) k přípravě aluminové pěny.TMA má v tomto případě dvojí roli, slouží jako zdroj hliníku a zároveň i jako zdroj methanu, který má funkci porogenu – látky, řídící tvorbu pórů.
Syntéza byla prováděna na plochém platě, které bylo zalito vodou. Do ní byl pomalu přikapáván TMA, až do doby, kdy byla hladina zcela pokryta vznikající pěnou. Poté byl produkt vysušen a dále kalcinován při teplotách 500–900 °C.
Vzniklý produkt byl charakterizován jako boehmit (AlOOH). Povrchovou analýzou byla zjištěna přítomnost mezopórů a z části i makropórů. Po kalcinaci došlo k transformaci boehmitu na g-aluminu a zároveň ke zvětšení pórů. Výhodou této metody je její jednoduchost a použití pouze jednoho prekurzoru (TMA).
Další možností transformace alkylů hlinitých je jejich oxidace. Jako oxidační činidlo lze využít kyslíkovou nebo ozónovou plasmu.Pro vlastní oxidaci byla využita metoda depozice vrstev atomů (ALD – Atomic Layer Deposition), která umožňuje přesné řízení tloušťky vznikajícího filmu. Depozice byla prováděna v reaktoru se studenou stěnou, který byl vybaven ATR-FTIR spektrometrem. Jako substrát byl použit přímo měřící ZnSe krystal spektrometru. Toto uspořádání umožňovalo přímé studium depozice pomocí ATR-FTIR. Zdrojem hliníku byl opět TMA.
V dřívějších studiích byly navrženy dva možné mechanismy oxidace TMA. V případě ozonu šlo o inserci atomu kyslíku do vazeb Al–C a Al–H a pro oxidaci kyslíkem byl navržen mechanismus podobný hoření, kdy jsou vznikající plyny – CO, CO2 a H2O – generovány hořením organických skupin –CH3 v alanu.Z výsledků studie vyplynulo, že jak v případě ozonu, tak i v případě kyslíku je mechanismus stejný. Jedná se o hoření, jehož produktem jsou –OH skupiny a uhličitany na povrchu filmu.
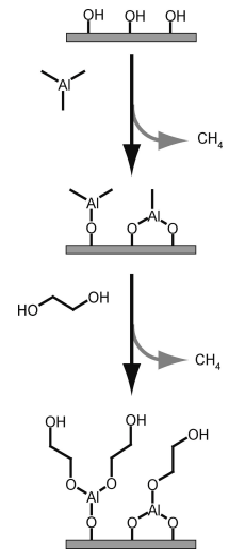
Obr. 3 Vznik aluconu pomocí MLD
Další možností, jak transformovat alkylalany na materiály na bázi oxidu hlinitého jsou reakce s vícefunkčními alkoholy. Reakce TMA s dioly jsou známé a vedou k alkylhlinitým diolátovým komplexům. První byl připraven v roce 1992 reakcí TMA a 1,2-dihydroxymethylbenzenem.
Pomocí techniky depozice molekulárních vrstev (MLD – molecular layer deposition), která je podobná ALD lze z TMA a ethylenglykolu připravit polymer alucon. Alucony jsou skupina polymerních hybridních alkoxidů hlinitých s řetězcem obsahujícím uhlík: –Al–O–R–O–Al–. Vznik polymeru schématicky popisuje obrázek 3. Nejprve dojde k reakci OH skupin na povrchu substrátu s TMA, tím se získá první monomolekulární vrstva obsahující hliník. Reakce se po zreagování všech OH skupin zastaví. V dalším kroku se odstraní přebytek TMA a vrstva se vystaví působení ethylenglykolu, dojde k vytvoření alkoxidové vazby, uvolnění methanu a na povrchu získaného filmu vzniknou znovu volné OH skupiny, které mohou dále reagovat s novou dávkou TMA.
Transformace karboxylátů hlinitých na oxid hlinitý
Další skupinou hlinitých prekurzorů vhodných pro přípravu oxidu hlinitého jsou karboxyláty. V roce 2003 byl popsán sonochemický rozklad hydroxo-bis(2-ethylhexanoátu) hlinitého. Sonolýza byla prováděna v n-dekanu, docházelo při ní k eliminaci ketenu a ke vzniku OH skupin na hliníkových atomech, které následně kondenzovaly za vzniku polyalumoxánů (RAlO)n.
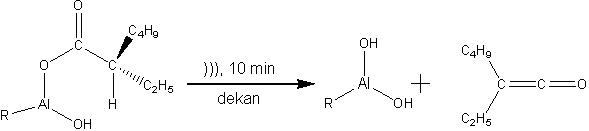
Obr. 4 Sonochemický rozklad karboxylátu hlinitého
Získaný produkt byl zahříván na 200 °C po dob 30 minut a poté kalcinován při teplotě 700 až 900 °C po dobu pěti hodin. Tímto postupem byl získán nanokrystalický g-Al2O3, jehož částice byly menší než 10 nm. Pokud byl do reakční směsi přidán další kovový prekurzor, např. 2-ethylhexanoát yttritý, byl produktem směsný oxid – granát Y3Al5O12.
Literatura
- Antelmann, B.; Chisholm, M.H.; Iyer, S.S.; Huffman, J.C.; Navarro-Llobet, D.; M., Simonsick; W. J., Zhong, W. Macromolecules 2001, 34, 3159-3175.
- Vioux, A. Chem. Mater. 1997, 9, 2292.
- Yanovskii, A.I.; Kozunov, V.A.; Turova, N.Ya.; Furmanova, N.G.; Stuchkov, Yu. T. Dokl. Akad. Nauk. SSSR 1979, 244, 119.
- Belanger-Gariepy, F.; Hoogsteen, K.; Sharma, V.; Wuest, J. D. Inorg. Chem. 1991, 30, 4140-4145.
- Szumacher S.; Kunicki, A.R.; Madura, I.; Zachara, J. J. Organometal. Chem. 2003, 682, 196-203.
- Mitra, A.; Wang, Y.; Parkin, S.; Atwood, D. Dalton Trans. 2008, 1037–1042.
- Gelbrich, T.; Düminchen, U.; Jörchel, P. Acta Cryst. 1999, C55, 856-858.
- Veith, M.; Wazir, H.U.; Kirs, T.; Huch, V.; Zimmer, M. Z. Anorg. Allg. Chem. 2011, 923-929.
- Li, Y.; Yang, X.Y.; Tian., G.; Vantomme, A.; Yu, J.; Tendeloo, G.V.; Su, B.L. Chem. Mater. 2010, 22, 3251-3258.
- Rai, V.R.; Vandalon, V.; Agarwal, S. Langmuir 2010, 26, 13732-13735.
- Goldstein, D.N.; McCormick, J.A.; George, S.M. J. Phys. Chem. C 2008, 112, 19530-19539.
- Heil, S.B.S.; Kudlacek, P.; Langereis, E.; Engeln, R.; van de Sanden, M.C.M.; Kessels, W. M. M. Appl. Phys. Lett. 2006, 89, 3.
- Langereis, E.; Keijmel, J.; van de Sanden, M. C. M.; Kessels, W. M. M. Appl. Phys. Lett. 2008, 92, 3.
- Pasynkiewicz, S.; Ziemkowska, W. J. Organomet. Chem. 1992, 423, 1-4.
- McMahon, C.N.; Alemany, L.; Callender, R.L.; Bott, S.G.; Barron, A.R. Chem. Mater. 1999, 11, 3181-3188.
- (a) Suslick, K. S. Science 1990, 247, 1439. (b) Flint, E. B.; Suslick, K. S. Science 1991, 253, 1397.
- Shafi, K.V.P.M.; Ulman, A.; Lai, J.; Yang, N.L.; Cui, M.H. J. Am. Chem. Soc. 2003, 125, 4010-4011.