Sodík, Na, je nejběžnější alkalický kov. Je to měkký, stříbrolesklý kov, sedmý nejrozšířenější prvek v zemské kůře (2,27 %). Ve vesmíru připadá jeden atom sodíku na zhruba 800 atomů vodíku.
| Atomové číslo | 11 | Počet stabilních izotopů | 1 |
| Atomová hmotnost | 22,98976828 | Elektronová konfigurace | [Ne] 3s1 |
| Teplota tání [°C] | 97,72 | Teplota varu [°C] | 883 |
| Elektronegativita | 0,93 | Hustota [g.cm-3] | 0,968 |
V zemské kůře se vyskytuje výhradně ve formě solí, pro jeho vysokou reaktivitu ho nenacházíme v čistém stavu. Velká množství sodíku jsou rozpuštěna v mořské vodě. Nejběžnějším minerálem je halit NaCl. Patří mezi biogenní prvky, proto je rozšířený i v živých organismech.
Izotopy
Jediným stabilním izotopem sodíku je 23Na. Na Zemi se ve stopových množstvích vyskytují ještě dva nestabilní izotopy:
| Izotop | Poločas rozpadu |
| 22Na | 2,60 roku |
| 23Na | stabilní |
| 24Na | 14,96 hodin |
22Na
Stopová množství tohoto izotopu vznikají interakcí kosmického záření s 40Ar v atmosféře.
Výroba
Kovový sodík se průmyslově vyrábí elektrolýzou eutektika 40 % NaCl a 60 % CaCl2 při teplotě asi 850 °C. Kovový sodík a vápník se vylučují na katodě, následně se oddělí pevný vápník od stále kapalného sodíku. Dalším produktem výroby je plynný chlor.


Vlastnosti
Reaguje prudce s vodou a s kyslíkem vytváří nejprve oxid a poté peroxid, pokud reakce probíhá ve vlhkém vzduchu, je konečným produktem hydroxid sodný. V plameni poskytuje intenzivní žluté zabarvení.
Sloučeniny
Chlorid sodný
Jednou z nejvýznamnějších sloučenin sodíku je chlorid sodný, NaCl. V potravinářství je známý jako kuchyňská sůl. Má ale i mnoho využití v jiných odvětvích průmyslu. Získává se z několika zdrojů, nejdůležitější je solanka (angl. Brine) a kamenná sůl. Kamenná sůl vytváří obrovská naleziště, obsahujících poměrně čistý NaCl (okolo 90 %).
V roce 2021 bylo publikováno video zobrazující vznik krystalu NaCl.[7]
Reakce sodíku s vodou
Sodík reaguje s vodou prudce za vzniku hydroxidu sodného a vodíku. Reakce je silně exotermní, uvolněné teplo dokáže roztavit kovový sodík.
2 Na + 2 H2O → 2 NaOH + H2
Ethoxid sodný
Ethoxid sodný je běžná báze využívaná v organické syntéze, poprvé ho připravil Liebig v roce 1837, jeho krystalovou strukturu se podařilo objasnit až v roce 2020.[6] Pevný ethoxid se skládá ze dvou fází, ethoxidu C2H5ONa a jeho ethanolátu C2H5ONa·2C2H5OH.
2 C2H5OH + 2 Na → 2 C2H5ONa + H2
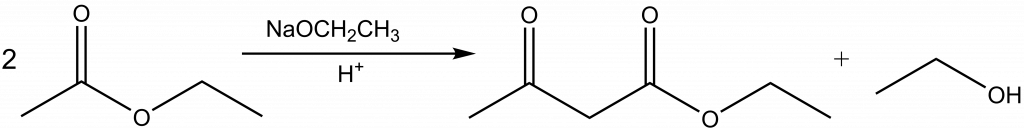
Využívá se jako báze v Claisenově kondenzaci, např. ethylacetátu:
NaK
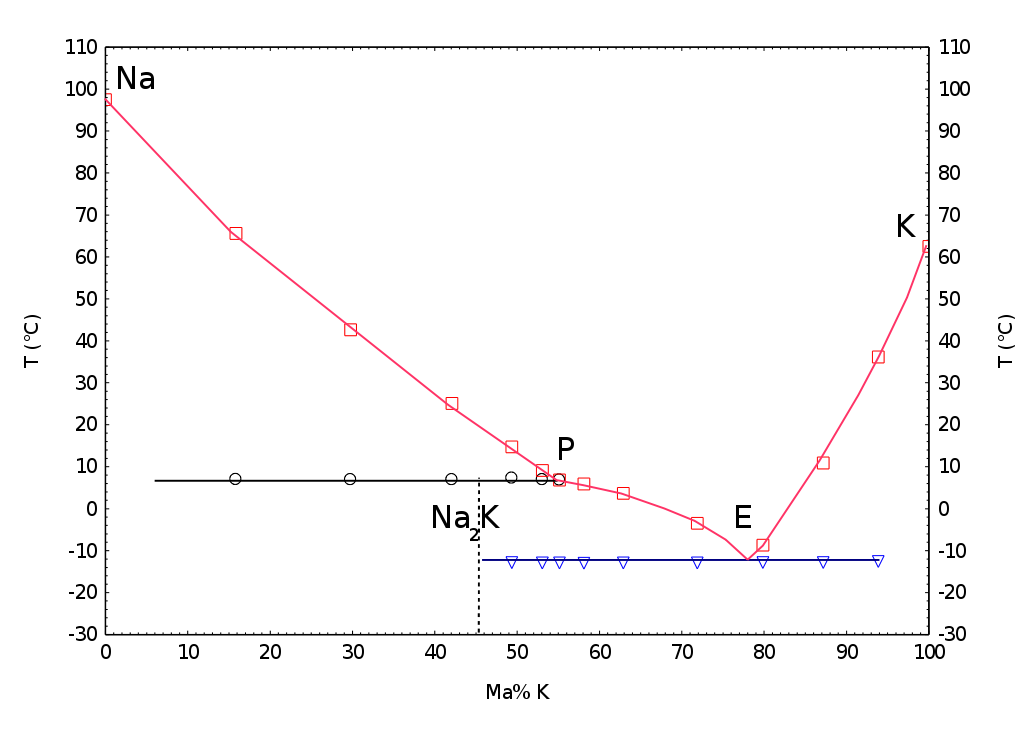
Slitina sodíku s draslíkem se označuje jako NaK, za laboratorní teploty je kapalná. Eutektikum tvoří při obsahu 77 % draslíku a 23 % sodíku, kdy má teplotu tání -13 °C.
Je to velmi reaktivní látka, lze s ní manipulovat jen v ochranné atmosféře argonu nebo dusíku, skladuje se pod vrstvou hexanu, příp. jiného uhlovodíku. Využívá se jako sušidlo pro organická rozpouštědla a jako chladící médium v některých typech jaderných reaktorů.[8]

V roce 2022 vyšlo pěkné review týkající se této slitiny.
Na2He
Působením plynného helia za vysokého tlaku vzniká fáze Na2He, kde ale není přitomna chemická vazba.[9]
NMR
Je známo okolo dvaceti izotopů sodíku, ale pouze 23Na je stabilní, jeho jaderný spin je 3/2. 23Na má střední citlivost, ale je kvadrupolární. Běžným standardem je roztok NaCl v D2O.
| 23Na | |
|---|---|
| Spin | 3/2 |
| Zastoupení v přírodě [%] | 100 |
| Citlivost vzhledem k 1H | 0,0927 |
| Citlivost vzhledem k 13C | 545 |
| Rezonanční frekvence v poli 1 T | 11,2688 |
| Jaderný magnetický moment | +2,217522 |
| Rozsah chemických posunů | 70 ppm; -62 až 10 ppm |
Jádro 23Na bude možná časem použitelné i v MRI.
23Na chemické posuny
| Sloučenina/Ion | Chemický posun [ppm] |
|---|---|
| Na+ (aq) | 10 – (-10) |
| NaCl | 0 |
| Organosodné sloučeniny | -3 – (-15) |
| Na– | -58 – (-62) |
Odkazy
- 23Na NMR
- Sodík na české wikipedii
- Sodík na anglické wikipedii
- Sodium MRI: Methods and Applications
- Čeští vědci zjistili proč sodík vybuchne ve vodě.
- Crystal structure of sodium ethoxide (C2H5ONa), unravelled after 180 years
- First-ever atomic resolution video of salt crystals forming in real time
- Sodium and NaK – Reactor Coolant
- A stable compound of helium and sodium at high pressure
Navigace
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| H | He | ||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr |
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe |
| Cs | Ba | La | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| Fr | Ra | Ac | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |
| Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu |
| Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr |
4 Replies to “Sodík”