Chlor, Cl, je toxický, žlutý plyn. Je to velmi reaktivní prvek, tvoří sloučeniny s většinou prvků. Má dva stabilní, NMR aktivní izotopy (35 a 37) a v laboratořích se setkáváme s dvěma nestabilními (36 a 38). Jde o dvacátý nejrozšířenější prvek na Zemi, vyskytuje se převážně ve formě chloridů. Ve sloučeninách se vyskytuje v oxidačních číslech -I, +I, +III, +V, +VII.
| Atomové číslo | 17 | Počet stabilních izotopů | 2 |
| Atomová hmotnost | 35,453 | Elektronová konfigurace | [Ne] 3s2 3p5 |
| Teplota tání [°C] | -101,5 | Teplota varu [°C] | -34,4 |
| Elektronegativita | 3,16 | Hustota [kg.m-3] | 3,2 |


Izotopy
Přírodní chlor se skládá ze dvou stabilních izotopů a stopového množství jednoho radioizotopu.
| Izotop | Poločas přeměny | Zastoupení [%] |
| 35Cl | stabilní | 75,76 |
| 36Cl | 3,01×105 let | stopové |
| 37Cl | stabilní | 24,24 |
36Cl
36Cl vzniká působením kosmického záření (tříštivou reakcí) na jádro 40Ar, jeho poločas rozpadu je 3,01×105 roků. Laboratorně se připravuje ostřelováním chloridu draselného neutrony v reaktoru: 35Cl(n,γ)36Cl.
Poločas přeměny tohoto izotopu umožňuje jeho využití při geologickém datování v rozmezí 60 000 až 1 milión let.
38Cl
38Cl se připravuje ostřelováním 37Cl neutrony: 37Cl(n,γ)38Cl, jeho poločas přeměny je 37,24 minut. Využívá se pro studium reakčních mechanismů.
Výskyt a výroba
Chlor je devatenáctý nejrozšířenější prvek v zemské kůře. Vyskytuje se pouze ve vázaném stavu, nejběžnější sloučeninou je chlorid sodný.
Laboratorně se připravuje reakcí kyseliny chlorovodíkové s manganistanem draselným nebo oxidem manganičitým.
16 HCl + 2 KMnO4 → 5 Cl2 + 2 KCl + 2 MnCl2 + 8 H2O
Průmyslová výroba je založena na elektrolýze vodných roztoků NaCl, případně jeho taveniny. V případě elektrolýzy roztoku vzniká jako vedlejší produkt NaOH, pokud elektrolyzujeme taveninu vzniká kovový sodík.
2 NaCl + 2 H2O → Cl2 + 2 NaOH + H2
2 NaCl(l) → Cl2 + 2 Na
Chemické vlastnosti
Při rozpouštění plynného chloru ve vodě dochází k disproporcionaci za vzniku kyseliny chlorovodíkové a chlorné. Kyselina chlorovodíková je jednou ze složek lučavky královské.
Cl2 + H2O → HCl-I + HClIO
Průmyslově se vyrábí elektrolýzou roztoku chloridu sodného, společně s hydroxidem sodným.
| Oxidační stav chloru | Název | Vzorec | Příklady |
|---|---|---|---|
| -I | Chloridy | Cl– | NaCl, organické chloridy |
| +I | Chlornany | ClO– | NaClO, Ca(ClO)2 |
| +III | Chloritany | ClO2– | NaClO2 |
| +IV | – | ClO2 | ClO2 oxid chloričitý |
| +V | Chlorečnany | ClO3– | NaClO3 |
| Chloryly | ClO2+ | [ClO2][SbF6] hexafluoroantimoničnan chlorylu | |
| +VI | – | Cl2O6 | Cl2O6 oxid chlorový – pouze formální ox. stav, molekula obsahuje chlor v oxidačním stavu V a VII |
| +VII | Chloristany | ClO4– | NaClO4 |
Oxokyseliny chloru
Chlor vytváří čtyři jednosytné oxokyseliny: chlornou (HClO, hypochlorous acid), chloritou (HClO2, chlorous acid), chlorečnou (HClO3, chloric acid) a chloristou (HClO4, perchloric acid). Od nich známe čtyři řady solí: chlornany, chloritany, chlorečnany a chloristany.
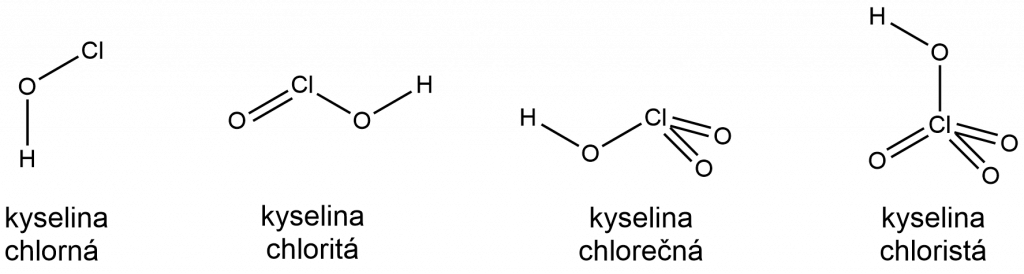
Kyselina chlorná vzniká zaváděním plynného chloru do vody, dochází k disproporcionaci chloru na kyselinu chlornou a chlorovodíkovou.
Cl2 + H2O → HClO + HCl
Pokud chceme připravit kyselinu chlornou bez chloridů, lze využít zavádění oxidu chlorného (Cl2O) do vody za teploty 0 °C. Kyselina chlorná je stabilnější než kyselina bromná nebo jodná.
Kyselina chloritá je nejméně stabilní kyselinou chloru. Stabilní je pouze ve zředěném roztoku. Lze ji připravit vytěsněním ze suspenze chloritanu barnatého.
Ba(OH)2 + H2O2 + Cl2O → Ba(ClO2)2 + 2 H2O + O2
Ba(ClO2)2 + H2SO4 → BaSO4 + 2 HClO2
Kyselina chlorečná se je silná kyselina, která je ve vodném roztoku stabilní do koncentrace asi 30 %. Připravuje se vytěsňováním kyselinou sírovou z chlorečnanů.
Ba(ClO3)2 + H2SO4 → BaSO4 + 2 HClO3
Kyselina chloristá je silná kyselina, je nejstabilnější z oxokyselin chloru. V čistém stavu vybuchuje při nárazu.
Chloristan sodný se využívá výchozí látka pro syntézu chloristanu amonného, který je součástí raketových paliv.
NaClO4 + NH4Cl → NH4ClO4 + NaCl
Chloristan sodný se připravuje elektrolytickou oxidací chlorečnanu sodného:
NaClO3 + H2O → NaClO4 + H2
NMR
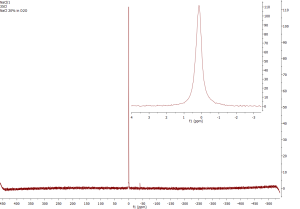
35Cl NMR
Jádro je kvadrupolární, takže i NMR signály jsou široké. 35Cl NMR je citlivější než 37Cl. Je velmi užitečné pro studium anorganických iontových sloučenin. Jako standard se používá NaCl. Organické sloučeniny poskytují velmi široké signály, proto je NMR použitelné pouze pro menší molekuly.
| Spin | 3/2 |
|---|---|
| Zastoupení v přírodě | 75,78 % |
| Jaderný magnetický moment | +0.8218743 |
| Rozsah chemických posunů | -50 až 1050 ppm |
| Relativní citlivost k 1H | 3,58×10-3 |
| Relativní citlivost k 13C | 21,0 |
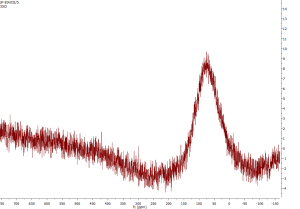
37Cl NMR
Méně citlivé než 35Cl, ale poskytuje užší signály.
| Spin | 3/2 |
|---|---|
| Zastoupení v přírodě | 24,22 % |
| Jaderný magnetický moment | +0.6841236 |
| Rozsah chemických posunů | -50 až 1050 ppm |
| Relativní citlivost k 1H | 6,59×10-4 |
| Relativní citlivost k 13C | 3,87 |
Odkazy
Navigace
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| H | He | ||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr |
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe |
| Cs | Ba | La | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| Fr | Ra | Ac | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |
| Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu |
| Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr |
U mocenství chloru VII jsou omylem uvedeny chlorečnany namísto chloristanů.