Chemická rovnováha je stav systému, kdy nedochází k makroskopickým změnám, ale v systému stále probíhají chemické děje.
Podmínky ustavení chemické rovnováhy:[2]
- Reakce musí být vratná
- Rychlost vzniku produktů je stejná, jako rychlost jejich rozkladu zpět na reaktanty
Každý systém směřuje do rovnovážného stavu a setrvává v něm tak dlouho, dokud nedojde ke změně vnějších podmínek.
V roce 1873 formuloval americký vědec J. W. Gibbs hypotézu, že je rovnováhy dosaženo, pokud je Gibbsova energie systému minimální. Rovnovážnou konstantu procesu pak můžeme dát do vztahu s Gibbsovou energií.
$$\Delta G_r^0 = -RT\ln K$$
kde R je molární plynová konstanta (8,314 J.K-1.mol-1) a T je termodynamická teplota.
Příkladem rovnovážného procesu je disociace kyseliny octové ve vodě. Kyselina octová je slabá, takže ve vodném roztoku existuje v disociované i nedisociované formě.
$$CH_3COOH + H_2O \leftrightarrow CH_3COO^- + H_3O^+$$
Rovnovážnou konstantu disociace můžeme vyjádřit pomocí rovnovážných koncentrací nebo aktivit jednotlivých sloučenin. Pokud je rovnovážná konstanta menší než 1 je rovnováha posunuta směrem k výchozím látkám, pokud je větší než 1 je rovnováha posunuta směrem k produktům.
$$K_c = \frac{[CH_3COO^-][H_3O^+]}{[CH_3COOH][H_2O]} = \frac{a_{(CH_3COO^-)}\ a_{(H_3O^+)}}{a_{(CH_3COOH)}\ a_{(H_2O)}}$$
Pro plynné systémy můžeme využít k definici rovnovážné konstanty parciální tlaky jednotlivých složek. Např. pro reakci vodíku s jodem:
H2 (g) + I2 (g) ⇌ 2 HI (g)
$$K_p = \frac{p(HI)^2}{p(H_2) p(I_2)}$$
Pokud jsou některé látky v reakci pevné, bereme jejich aktivitu (a tím i parciální tlak) jako jednotkovou, např. pro disproporcionaci oxidu uhličitého platí:
2 CO (g) ⇌ CO2 (g) + C (s)
$$K = \frac{[CO_2][C]}{[CO]^2} = \frac{[CO_2].1}{[CO]^2} = \frac{p(CO_2)}{p(CO)^2}$$
Le Chatelierův princip
Systém, který je v rovnováze, reaguje na každou změnu (teploty, tlaku, koncentrace, atd.) tak, aby tuto změnu potlačil.
Princip formuloval francouzský chemik Henry Louis Le Châtelier.
Vliv teploty
Rovnováhu endotermní (reakce, které musíme dodávat teplo) reakce posuneme směrem k produktům zahřátím, naopak u exotermní reakce musíme systém chladit, abychom rovnováhu posunuli směrem k produktům.
Vliv tlaku
Vliv tlaku pozorujeme u reakcí, kde je alespoň jedna složka v plynné fázi a kde dochází během reakce ke změně tlaku. To jestli dochází ke změně tlaku poznáme snadno pomocí stechiometrických koeficientů u plynných složek reakce. Obecně platí, že se zvýšením tlaku posune rovnováha posune tím směrem, kde je menší látkové množství plynů. Jako příklad si můžeme uvést reakci vodíku s dusíkem:
3 H2 (g) + N2 (g) ⇌ 2 NH3 (g)
$$K = \frac{p(NH_3)^2}{p(H_2)^3\ p(N_2)}$$
Na levé straně reakce máme celkem čtyři moly plynu (3 moly vodíku a 1 mol dusíku), na pravé straně pak pouze dva moly. To znamená, že tlak během reakce klesá, takže např. zvýšením tlaku vodíku nebo zmenšením objemu reaktoru posuneme rovnováhu směrem k produktům.
Pokud bychom zvýšili tlak přidáním inertního plynu, např. helia nebo argonu, nedošlo by k posunu rovnováhy, protože by se nezměnily hodnoty parciálních tlaků.
Vliv koncentrace
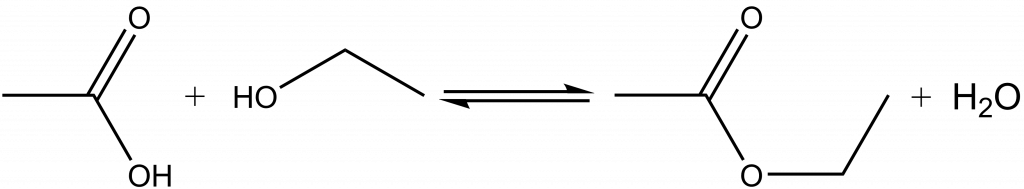
Rovnováhu můžeme posunout směrem k produktům buď přidáváním jednoho z reaktantů a nebo odebíráním produktu. Toho se v praxi využívá např. u esterifikací, kdy se z reakční směsi oddestilovává vznikající voda.
Odkazy
- Chemická rovnováha
- Chemical equilibrium in IUPAC Goldbook
- Le Chatelier’s principle
- Schlenkova rovnováha – rovnovážný děj pozorovaný u Grignardových sloučenin
Další kapitoly
- České chemické názvosloví
- Platné číslice a měření
- Základní chemické zákony
- Důležité veličiny a vztahy v chemii
- Výpočet stechiometrického vzorce
- Chemické rovnice a stechiometrické výpočty
- Koncentrace roztoků
- Rozpustnost, součin rozpustnosti
- Stavba atomu
- Periodická tabulka prvků a periodicita vlastností
- Chemická vazba
- VSEPR
- Komplexní sloučeniny
- Magnetické vlastnosti látek
- Termodynamika
- Chemická rovnováha
- Skupenské stavy látek
- Fázové rovnováhy
- Teorie kyselin a zásad
- pH, aktivita roztoku
- Elektrochemie
- Symetrie molekul
- Laboratorní technika
- Lineární regrese
- Jednotky tlaku
- Jednotky teploty
- Mohsova stupnice tvrdosti minerálů
- Odkazy
- Prezentace k semináři z obecné chemie