Měď je načervenalý, kovový prvek, který je znám a používán již od starověku. První známky o využívání mědi člověkem pocházejí z období 5000 – 4000 let př.n.l. V přírodě ji nacházíme např. v malachitu.
| Atomové číslo | 29 | Počet stabilních izotopů | 2 |
| Atomová hmotnost | 63,546 | Elektronová konfigurace | [Ar] 3d10 4s1 |
| Teplota tání [°C] | 1084,62 | Teplota varu [°C] | 2562 |
| Elektronegativita | 1,90 | Hustota [g.cm-3] | 8,94 |
Měď je z kovů 11. skupiny nejméně ušlechtilá, lze to demonstrovat pomocí hodnoty elektrodového potenciálu:
| Cu2+/Cu | 0,337 |
| Ag+/Ag | 0,80 |
| Au+/Au | 1,83 |
Izotopy mědi
Přírodní měď se skládá ze dvou stabilních izotopů, dále známe 27 radioizotopů. Radioizotopem s nejdelším poločasem přeměny je 67Cu (61,83 hodiny).[7]
| Izotop | Zastoupení [%] |
| 63Cu | 69,15 |
| 65Cu | 30,85 |
Výroba mědi
Velká část mědi se získává recyklací, z přírodních zdrojů se využívají hlavně sulfidické rudy, např. chalkocit (Cu2S) nebo chalkopyrit (CuFeS2). Ty se praží na vzduchu, čímž dochází k částečné oxidaci:
2 Cu2S + O2 → 2 Cu2O + SO2
Oxid je poté redukován sulfidem za vzniku surové mědi, uvolněný oxid siřičitý se využívá při výrobě kyseliny sírové.
2 Cu2O + Cu2S → 6 Cu + SO2
Surová měď se následně čistí elektrolýzou, jako elektrolyt slouží modrá skalice, CuSO4.5H2O.
Využití
Měděné vodiče
Měď je velmi důležitá pro konstrukci vodičů elektrického proudu, využívá se již od 20. let 18. století. V současnosti (2017) se s měděnými kabely můžeme potkat při výrobě elektrické energie, jejím přenosu, v telekomunikační technice, elektronických obvodech a mnoha dalších aplikacích.

Měď má nejvyšší elektrickou vodivost z běžných kovů: 16,78 nΩ·m při 20 °C.
Na dostupnosti mědi jsou silně závislé plány přechodu na zelené zdroje energie a na decentralizaci energetických zdrojů. Na začátku roku 2024 byl předpovězen prudký nárůst ceny mědi.[8]
Chemické vlastnosti
Měď se nerozpouští v neoxidujících kyselinách bez přítomnosti vzduchu, jedinou výjimkou je horká koncentrovaná kyselina sírová s níž reaguje podle rovnice:
Cu + 2 H2SO4 → SO2 + CuSO4 + 2 H2O
Měď vytváří sloučeniny v oxidačních číslech 0, I, II, III a IV.
Sloučeniny v oxidačním čísle 0 jsou většinou nestabilní, příkladem může být [Cu2(CO)6], který byl izolován v matrici.[5]
Sloučeniny v oxidačním čísle I, mědné sloučeniny, jsou poměrně běžné a mají značný význam. Ion Cu+ má v nich konfiguraci d10, tzn. že jsou diamagnetické a ve většině případů bezbarvé. Je to měkká kyselina, takže se ochotně váže s měkkými zásadami, např. sírou a fosforem, ale známy jsou i komplexy s kyslíkem a dusíkem jako donorovými atomy.
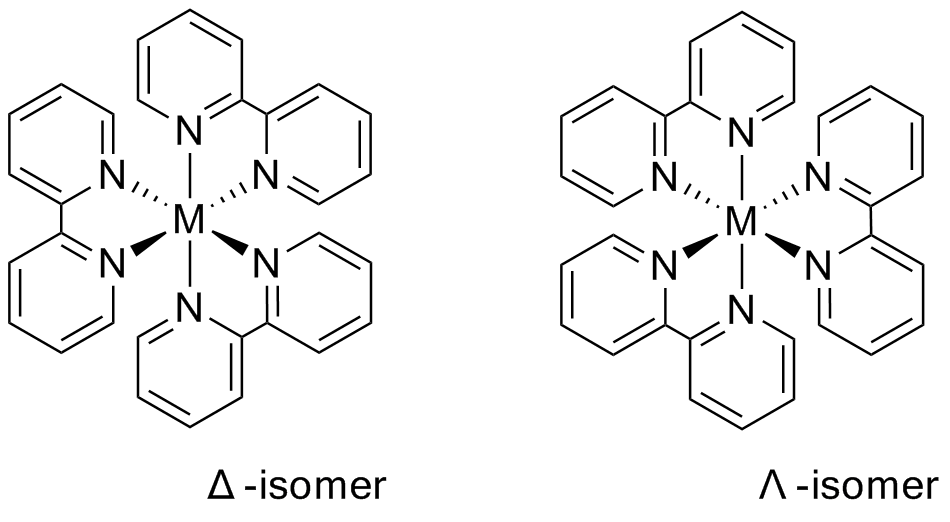
V oxidačním stavu II má měď konfiguraci d9, z toho důvodu se v měďnatých sloučeninách uplatňuje, v různé míře Jahnův-Tellerův efekt. Příkladem může být ion [Cu(bpy)3]2+, kde jsou čtyři vazby Cu-N stejně dlouhé a zbylé, axiální, dvě jsou delší.[6] Měďnatý ion v komplexních sloučeninách má koordinační číslo v rozmezí 4-6.
Ve vysokoteplotních supravodičích typu YBCO se setkáváme s mědí v oxidačním čísle III, obecný vzorec je YBa2Cu3O7-x (x = 0-1). Další známé sloučeniny jsou např. Cs3[CuF6], KCuO2.
Oxidační číslo IV nacházíme u mědi vzácně, lze jej dosáhnout např. fluorací CsCuCl3 při 250 °C, která poskytuje červenou sloučeninu Cs2CuF6. Měď má v tomto komplexu konfiguraci d7 a oktaedr je deformován vlivem Jahnova-Tellerova efektu.
2 CsCuCl3 + 2 CsF + 5 F2 → 2 Cs2CuF6 + Cl2
Modrá skalice
Jako modrá skalice se označuje pentahydrát síranu měďnatého, CuSO4 . 5 H2O, který krystaluje jako modrá látka. V bezvodém stavu je bílý. Používá se jako herbicid a fungicid.


Dehydratace modré skalice probíhá ve dvou krocích, jak je vidět z termogravimetrické křivky:
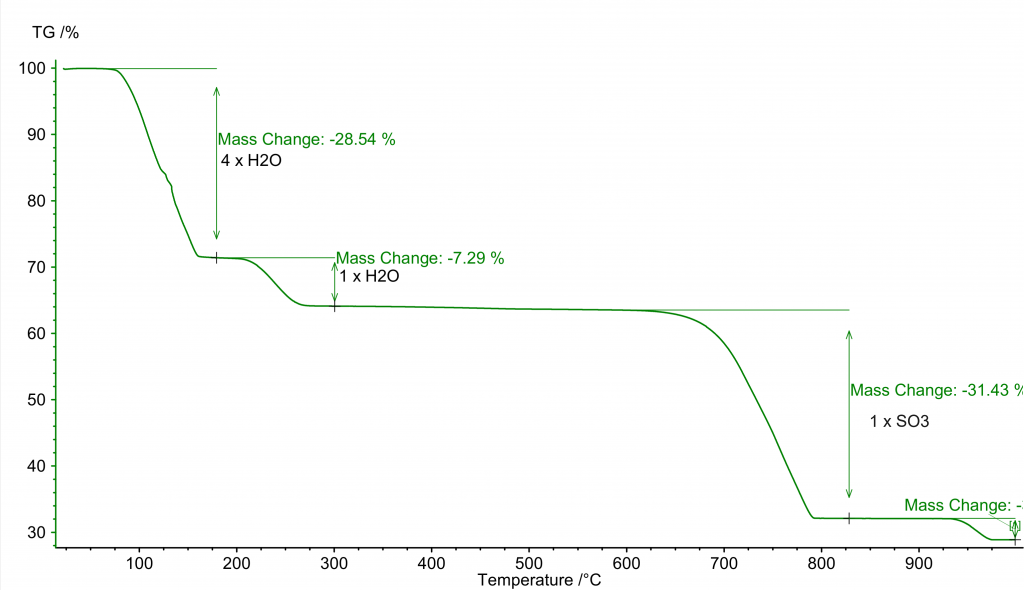
Modrou skalici nelze připravit přímou reakcí mědi s kyselinou sírovou. Elektrodový potenciál mědi je kladný (+0,34 V), proto nedokáže vytěsnit vodík z neoxidující kyseliny. Přípravu lze provést reakcí s koncentrovanou kyselinou sírovou za horka. Nejprve dochází k oxidaci a následně ke vzniku síranu:
Cu + H2SO4 → CuO + SO2 + H2O
CuO + H2SO4 → CuSO4 + H2O
Celková rovnice je tedy:
Cu + 2 H2SO4 → CuSO4 + SO2 + 2 H2O
Alternativní možností je využití kyseliny dusičné k oxidaci:
Cu + 2 HNO3 → CuO + 2 NO + H2O
CuO + H2SO4 → CuSO4 + H2O
Biochemie
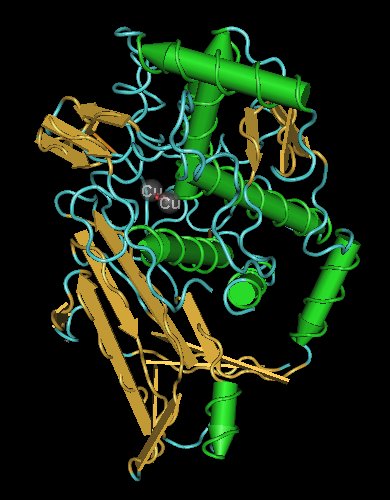
Měď je součástí hemocyaninu, bílkoviny, která má u některých měkkýšů podobnou funkci jako hemoglobin u savců. Obsahuje dva ionty mědi, v oxidovaném stavu jde o měďnaté ionty, v redukovaném o měďné. Také se nachází v superoxid dismutázách, kde slouží k přeměně toxického superoxidu na méně toxický peroxid, který je následně rozkládán dalšími enzymy.
Dospělý člověk má v těle přibližně 1,4-2,1 mg mědi na kilogram hmotnosti, kterou je potřeba doplňovat stravou.
NMR
Standardem je roztok [Cu(CH3CN)4][ClO4].
63Cu NMR
Toto jádro se měří častěji, protože je citlivější než 65Cu, ale poskytuje mírně širší signály.
| Spin | 3/2 |
|---|---|
| Zastoupení v přírodě | 69,17 % |
| Jaderný magnetický moment | +2,22329 |
| Rozsah chemických posunů | -300 až 800 ppm |
| Relativní citlivost k 1H | 0,0650 |
| Relativní citlivost k 13C | 382 |
65Cu NMR
Méně citlivé jádro než 63Cu, ale poskytuje užší signály.
| Spin | 3/2 |
|---|---|
| Zastoupení v přírodě | 30,83 % |
| Jaderný magnetický moment | +2,38167 |
| Rozsah chemických posunů | -300 až 800 ppm |
| Relativní citlivost k 1H | 0,0354 |
| Relativní citlivost k 13C | 208 |
Odkazy
- Měď na české wikipedii
- Měď na anglické wikipedii
- Copper NMR
- Origin of the Exotic Blue Color of Copper-Containing Historical Pigments
- Huber, H.; Kündig, E.P.; Moskovits, M.; Ozin, G.A. J. Am. Chem. Soc. 1974, 97, 2097-2106. DOI: 10.1021/ja00841a017
- Wolciechowska, A.; Pietraszko, A.; Bronowska, W.; Staszak, Z.; Jeziersk, J. ; Cieslak-Golonka, M. Polyhedron 2010, 29, 2574-2581. DOI: 10.1016/j.poly.2010.06.003
- Isotopes of copper
- Copper could skyrocket over 75% to record highs by 2025 — brace for deficits, analysts say
Navigace
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| H | He | ||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr |
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe |
| Cs | Ba | La | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| Fr | Ra | Ac | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |
| Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu |
| Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr |
11 Replies to “Měď”