Manganometrie je metoda redoxní odměrné analýzy, jako odměrný roztok využívá manganistan draselný. Titrace se zpravidla provádí v kyselém prostředí, kdy dochází k redukci manganistanu na manganatou sůl. V tomto případě není nutné používat indikátor, bod ekvivalence určíme růžovým zabarvením roztoku, které způsobí první nadbytečná kapka odměrného roztoku.
MnO4– + 8 H+ + 5 e– → Mn2+ + 4 H2O
V neutrálních nebo slabě zásaditých roztocích probíhá redukce jen na manganičité ionty:
MnO4– + 2 H2O + 3 e– → MnO2 + 4 OH–
Roztoky manganistanu nejsou příliš stabilní, pomalu se z nich uvolňuje kyslík a vzniká manganan a oxid manganičitý (burel), který tento rozklad katalyzuje a tím urychluje. Proto je nutné pravidelně stanovovat přesnou koncentraci manganistanu na vhodnou základní látku.
2 KMnO4 → K2MnO4 + MnO2 + O2
Jako základní látky se využívají dihydrát kyseliny šťavelové nebo šťavelan sodný, příp. draselný. Tyto látky je možné velmi přesně navážit a využít ke stanovení přesné koncentrace odměrného roztoku.
5 HOOC–COOH + 2 MnO4– + 6 H+ → 10 CO2 + 2 Mn2+ + 8 H2O
Příklady stanovení
Stanovení železnatých
Železnaté soli můžeme titrovat klasicky, dochází k oxidaci na železité soli:
5 Fe2+ + MnO4– + 8H+ → Mn2+ + 5 Fe3+ + 4 H2O
Aby nebylo stanovení bodu ekvivalence ovlivněno barvou vznikajících železitých solí, přidává se před titrací do baňky tzv. Reinhardtův–Zimmermannův roztok, ten se skládá z kyseliny sírové, kyseliny fosforečné (ruší zbarven způsobené železitými ionty) a síran manganatý (urychluje průběh reakce).
Stanovení železitých solí
Železité soli už samozřejmě manganistan nedokáže oxidovat, prvním krokem je tedy jejich redukce. K tomu se nejčastěji využívá chlorid cínatý:
2 Fe3+ + Sn2+ → 2 Fe2+ + Sn4+
Nadbytek redukčního činidla je samozřejmě nutné odstranit, aby nedošlo k ovlivnění titrace. Chlorid cínatý se odstraňuje srážením kalomelu (Hg2Cl2) roztokem chloridu rtuťnatého:
2 HgCl2 + Sn2+ → Hg2Cl2 + Sn4+ + 2 Cl–
Získané železnaté soli se dále titrují klasicky.
Stanovení peroxidu vodíku
Manganistan oxiduje peroxid za vzniku plynného kyslíku:
5 H2O2 + 2 MnO4– + 6 H+ → 5 O2 + 2 Mn2+ + 8 H2O
Stanovení organických látek
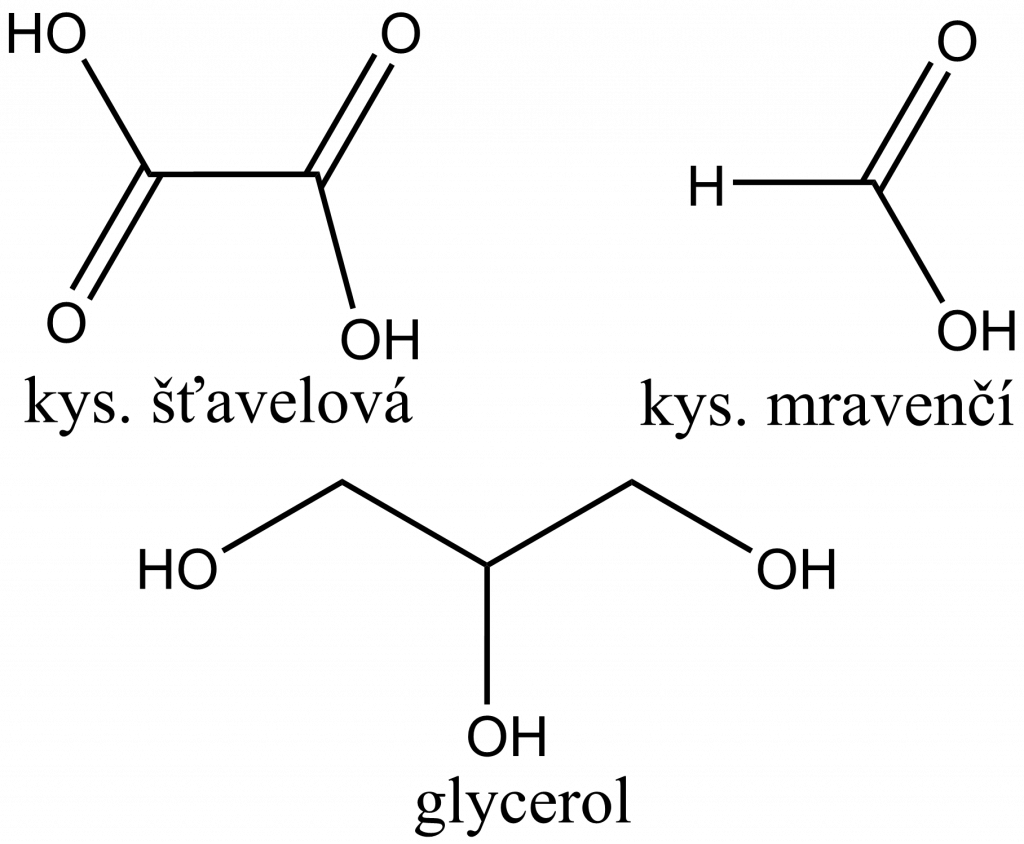
Manganometricky lze stanovit koncentraci kyseliny šťavelové a jejich solí, mravenčnanu, glycerolu a dalších látek.
Organické látky jsou zpravidla oxidovány až na oxid uhličitý:
5 HOOC–COOH + 2 MnO4– + 6 H+ → 10 CO2 + 2 Mn2+ + 8 H2O
Příklad výpočtu
0,5258 g chloridu železnatého (FeCl2) bylo kvantitativně rozpuštěno v odměrné baňce o objemu 100 cm3. Na titraci bylo pipetováno 20 cm3 odměrného roztoku KMnO4 o koncentraci 0,01 M. Průměrná spotřeba byla 14,61 cm3. Vypočítejte čistotu chloridu železnatého.
Řešení
Nejprve potřebujeme rovnici, viz výše:
5 Fe2+ + MnO4– + 8 H+ → Mn2+ + 5 Fe3+ + 4 H2O
Z rovnice vidíme, že faktor titrace (poměr stechiometrických koeficientů) bude:
$$\textrm{f}_\textrm{t}\ =\ \frac{\nu_{\textrm{Fe}}}{\nu_{\textrm{KMnO}_4}}\ =\ \frac{5}{1}\ =\ 5$$
Zřeďovací faktor bude 5, protože jsme pipetovali 20 cm3 ze 100 cm3 odměrné baňky.
Látkové množství chloridu železnatého vypočítáme jako součin faktoru titrace, zřeďovacího faktoru, koncentrace manganistanu a jeho průměrné spotřeby:
n = ft . fz . c . V = 5 . 5 . 0,01 . 0,01461 = 0,00365 mol FeCl2
Pro výpočet čistoty musíme převést látkové množství na hmotnost:
m = n . M = 0,00365 . 126,75 = 0,4626 g FeCl2
Výpočet čistoty je pak už snadný:
$$\textrm{w}\ =\ \frac{\textrm{m}}{\textrm{m}_\textrm{c}}\ =\ \frac{0,4626}{0,5258}\ =\ 0,8798$$
Čistota chloridu železnatého je 87,98 %.
Literatura
- Manganometrie na české wikipedii
- Redox Titrations. Potassium Permanganate.
Další kapitoly
- České chemické názvosloví
- Platné číslice a měření
- Základní chemické zákony
- Důležité veličiny a vztahy v chemii
- Výpočet stechiometrického vzorce
- Chemické rovnice a stechiometrické výpočty
- Koncentrace roztoků
- Rozpustnost, součin rozpustnosti
- Stavba atomu
- Periodická tabulka prvků a periodicita vlastností
- Chemická vazba
- VSEPR
- Komplexní sloučeniny
- Magnetické vlastnosti látek
- Termodynamika
- Chemická rovnováha
- Skupenské stavy látek
- Fázové rovnováhy
- Teorie kyselin a zásad
- pH, aktivita roztoku
- Elektrochemie
- Symetrie molekul
- Laboratorní technika
- Lineární regrese
- Jednotky tlaku
- Jednotky teploty
- Mohsova stupnice tvrdosti minerálů
- Odkazy
- Prezentace k semináři z obecné chemie