Krypton, Kr, patří mezi vzácné plyny. Tvoří pouze několik nestabilních sloučenin s fluorem a kyslíkem, jinak je zcela inertní. Je využíván ve světelných zdrojích.
| Atomové číslo | 36 | Počet stabilních izotopů | 4 |
| Atomová hmotnost | 83,798 | Elektronová konfigurace | [Ar] 3d10 4s2 4p6 |
| Teplota tání [°C] | -157,36 | Teplota varu [°C] | -153,22 |
| Elektronegativita | 3,00 | Hustota [g.cm-3] | 0,003749 |
Izotopy kryptonu
Přírodní kryton se skládá z pěti stabilních a dvou nestabilních izotopů.
| Izotop | Zastoupení v přírodě [%] | Poločas rozpadu |
| 78Kr | 0,36 | 9,2 . 1021 let |
| 80Kr | 2,29 | stabilní |
| 81Kr | stopy | 2,3 . 105 let |
| 82Kr | 11,59 | stabilní |
| 83Kr | 11,50 | stabilní |
| 84Kr | 56,99 | stabilní |
| 86Kr | 17,28 | stabilní |
81Kr
Poločas přeměny je 230 000 let, elektronovým záchytem se přeměňuje na 81Br:
$$^{81}_{36}\textrm{Kr}\ \overset{EZ}{\rightarrow}\ ^{81}_{35}\textrm{Br}$$
V zemské atmosféře vzniká interakcí s protony a neutrony kosmického záření, např.:
$$^{80}_{36}\textrm{Kr}\ +\ ^1_0\textrm{n}\ \rightarrow\ ^{81}_{36}\textrm{Kr}\ +\ \gamma \\
^{82}_{36}\textrm{Kr}\ +\ \gamma\ \rightarrow\ ^{81}_{36}\textrm{Kr}\ +\ ^1_0\textrm{n}$$
Chemické vlastnosti
Jedinou dosud známou stabilní sloučeninou je fluorid KrF2, bezbarvá pevná látka, která se při teplotách nad -25 °C rozkládá. Molekula má lineární tvar, vazebná délka je 189 pm. Se silnými Lewisovými kyselinami tvoří anionty KrF+ a Kr2F3+. Jeho roztok v HF má při laboratorní teplotě v 19F NMR posun cca 56 ppm. Tvoří dvě krystalické fáze, α-KrF2 s primitivní tetragonální základní buňkou a β-fází, která krystaluje v prostorové grupě P42/mnm.
Lze jej připravit čtyřmi metodami:[3]
- Pomocí elektrického výboje – na směs kryptonu a fluoru v poměru 1:1 až 2:1 necháme působit elektrický výboj za tlaku 40 až 60 torrů po dobu několika hodin. Výroba probíhá za teploty kapalného kyslíku.
- Bombardováním elektrony a protony[6] – v roce 1963 byla popsána příprava KrF2 použitím 1,5 MeV proudu elektronů. Lze využít i proud protonů s vyšší energií, 10 MeV a proudu 5 μA, kterým působíme na směs kryptonu a fluoru při teplotách -60 až -140 °C. Rychlost získávání produktu je okolo 1 g.h-1.
- Fotochemicky – fotochemická příprava byla poprvé publikována roku 1965, kdy byla směs Kr a F2 ozařována slunečním světlem po dobu pěti týdnů za teploty -78 °C. Lepších podmínek bylo později dosaženo se rtuťovou výbojkou při teplotě -196 °C.
- Na žhaveném vlákně – tato metoda je založena na disociaci fluoru na žhaveném vlákně při teplotě 700 °C. Reakční nádoba je chlazena na -196 °C. Rychlost produkce je až 6 g.h-1.
Chemicky se chová jako donor fluoridu, s pentafluoridy, např. NbF5 vytváří iontové sloučeniny s kationty KrF+ nebo Kr2F3+.
Mimoto tvoří krypton také řadu klathrátů[5] a endohedrálních derivátů fullerenů.
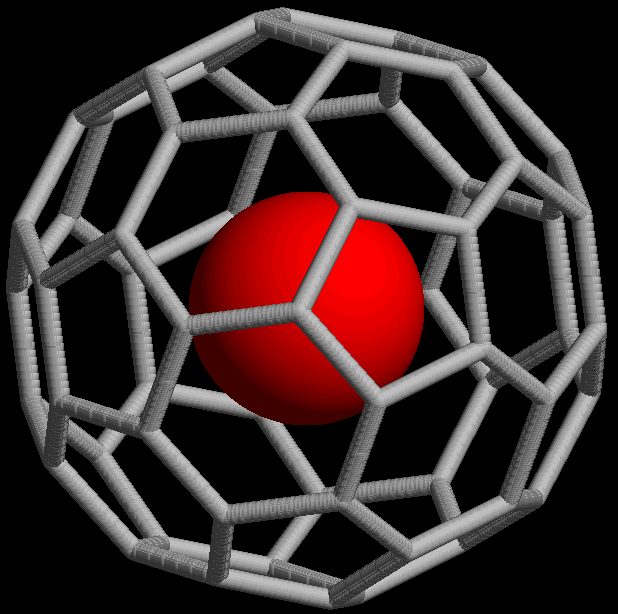
NMR
Krypton má jediný NMR aktivní izotop, 83Kr, který má nízkou citlivost a spin 9/2, takže je kvadrupolární. Díky tomu, že většinou je atom kryptonu umístěn v symetrickém okolí, tak jsou signály poměrně úzké.
| 83Kr | |
|---|---|
| Spin | 9/2 |
| Zastoupení v přírodě [%] | 11,49 |
| Citlivost vzhledem k 1H | 0,00190 |
| Rezonanční frekvence v poli 1 T | 1,6442 |
Odkazy
- Krypton na české wikipedii
- Krypton na anglické wikipedii
- Lehmann, J.F.; Mercier, H.P.A.; Schrobilgen, G.J. Coord. Chem. Rev. (2002) 1-39. The chemistry of krypton
- 83Kr NMR
- Miyahara, Y., Abe, K. and Inazu, T. (2002), “Molecular” Molecular Sieves: Lid-Free Decamethylcucurbit[5]uril Absorbs and Desorbs Gases Selectively. Angew. Chem. Int. Ed., 41: 3020–3023. doi: 3.0.CO;2-4″ target=“_blank“>10.1002/1521-3773(20020816)41:16<3020::AID-ANIE3020>3.0.CO;2-4
- D.R. MacKenzie, Science 141 (1963) 1171. Krypton Difluoride: Preparation and Handling.
Navigace
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| H | He | ||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr |
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe |
| Cs | Ba | La | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| Fr | Ra | Ac | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |
| Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu |
| Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr |
One Reply to “Krypton”