Jod patří mezi halogeny, je to důležitý biogenní prvek. Tvoří tmavě fialové, destičkové krystaly. Je slabě rozpustný ve vodě, po přídavku jodidu vytvoří trijodidový anion, I3–, který je rozpustný velmi dobře. V přírodě se vyskytuje hlavně jako jodid v mořské vodě.
| Atomové číslo | 53 | Počet stabilních izotopů | 1 |
|---|---|---|---|
| Atomová hmotnost | 126,90447 | Elektronová konfigurace | [Kr] 4d10 5s2 5p5 |
| Teplota tání [°C] | 113,7 | Teplota varu [°C] | 184,3 |
| Hustota | 4,933 |
Izotopy
Jod má jediný stabilní izotop, 127I. Známe 36 radioizotopů, v přírodě se ve stopových množstvích vyskytuje radioizotop 129I.
129I
Tento izotop se přeměňuje mechanismem β− za vzniku 129Xe, poločas přeměny je 1,57.107 let.
$$^{129}_{\ \ 53}\textrm{I}\ \rightarrow\ ^{129}_{\ \ 54}\textrm{Xe}\ +\ ^{\ \ \ 0}_{-1}\beta^-$$
Do životního prostředí se dostal hlavně během jaderných testů v 50. a 60. letech. Malá množství vznikají i přirozenou cestou, samovolným rozpadem uranu a také interakcí atmosférického xenonu s kosmickým zářením.
Výskyt a objev
Jód je vzácný v zemské kůře i v naší sluneční soustavě. Nejvíce se ho nachází v mořské vodě, to je způsobeno dobrou rozpustností jodidů. Metabolismem mořských živočichů vznikají i organoiodové sloučeniny, nejčastěji jde o jodomethan (CH3I). Známe celkem 37 izotopů jodu, přírodní jod je monoizotopický, ostatní známé izotopy jsou nestabilní.
Objeven byl roku 1811, francouzským chemikem Bernardem Curtoisem, během extrakce popela mořských chaluh kyselinou sírovou, kdy docházelo k uvolnění par jodu. Nazván byl podle jeho fialové barvy, ioeidés – fialový.
První minerál jódu byl objeven roku 1852 v Mexiku, jednalo se o jodargyrit, AgI. Dalšími minerály obsahujícími jód jsou lautarit, Ca(IO3)2 a dietzeir, Ca2[CrO4(IO3)2]·H2O.

Chemické vlastnosti
Vytváří sloučeniny v oxidačních stavech od -I do VII. Nejdůležitější jsou jodidy (I-I). Přídavek jodidu k vodnému roztoku jodu značně zvýší rozpustnost jódu v důledku tvorby trijodidu I3–. Tento ion je lineární (v souladu s teroií VSEPR), délka vazby I-I je delší než v případě I2.
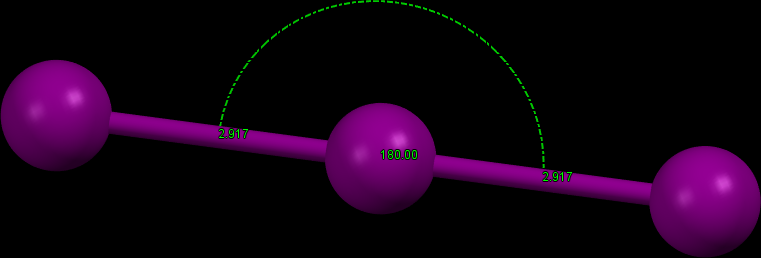
Obr. 2: Struktura trijodidového aniontu v molekule (Xanthotoxin)2·KI3.[4] Délka vazby I-I je 291,7 pm a molekula je lineární.
Je také součástí interhalogenových sloučenin.
Elementární jód má oxidační i redukční vlastnosti, toho se využívá v redoxní odměrné analýze – jodometrii.
Oxokyseliny jodu
Kyselina jodná (HIO) je slabá kyselina (Ka = 3×10-11). Snadno disproporcionuje podle rovnice:
5 HIO → HIO3 + 2 I2 + 2 H2O
Jodnany lze připravit reakcí jódu s hydroxidy alkalických kovů, rychle ale disproporcionují na jodidy a jodičnany.
3 KIO → KIO3 + 2 KI
Kyselina joditá (HIO2) je silně nestabilní, stejně jako její soli.[5]
Kyselina jodičná (HIO3) je bílá, ve vodě rozpustná pevná látka. Je to poměrně silná kyselina (Ka = 1,8×10-1), ve vodném roztoku má silné oxidační vlastnosti.
Lze ji připravit oxidací jodu pomocí dýmavé kyseliny dusičné, příp. chloru nebo elektrolyticky.
I2 + 6 H2O + 5 Cl2 ⇌ 2 HIO3 + 10 HCl
Další možností je oxidace chlorečnanu jodem:
I2 + 2 NaClO3 → 2 NaIO3 + Cl2
Kyselina jodistá je známá v několika formách, metajodistá HIO4, pentahydrogenjodistá H5IO5 a trijodistá H7I3O14.
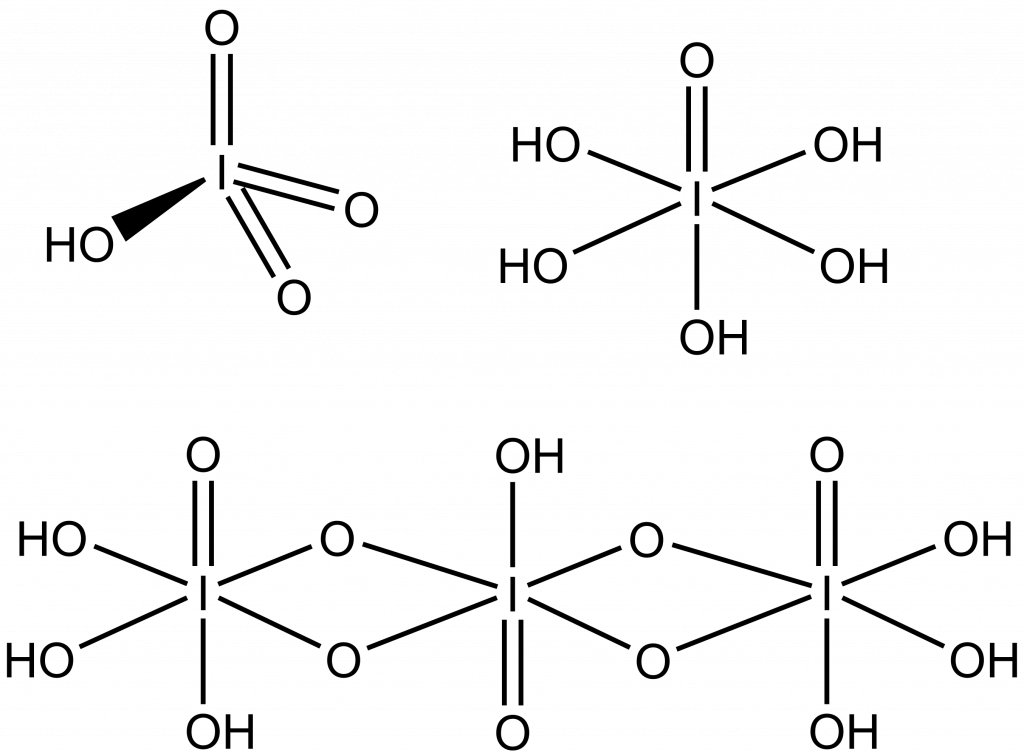
Hodnota Ka kyseliny metajodisté nebyla dosud stanovena, u kyseliny pentahydrogenjodisté pozorujeme disociaci až do třetího stupně:
| Stupeň disociace | Ka | pKa |
| 1 | 5,13×10-4 | 3,29 |
| 2 | 4,90×10-9 | 8,31 |
| 3 | 2,51×10-12 | 11,60 |

Jodistany kovů alkalických zemin lze připravit termickým rozkladem iodičnanů:
5 Ba(IO3)2 → Ba5(IO6)2 + 4 I2 + 9 O2
Kyselina jodistá a jodistany je silná oxidační činidla, jejich oxidační potenciál je nejvyšší v kyselém roztoku, se stoupající hodnotou pH pak jeho hodnota klesá. Kyselý roztok jodistanu dokáže oxidovat manganaté ionty na manganistan.
Jodistany alkalických kovů, např. NaIO4, se využívají k oxidačnímu štěpení diolů, produktem jsou ketony:

NMR
Jod má jeden NMR aktivní izotop, 127I, který je kvadrupolární a středně citlivý. Šířka linií je velká, proto se toto jádro příliš nevyužívá. Standardem je roztok KI v D2O.
| 127I | |
|---|---|
| Spin | 5/2 |
| Zastoupení v přírodě [%] | 100 |
| Citlivost vzhledem k 1H | 0,0954 |
| Citlivost vzhledem k 13C | 560 |
| Rezonanční frekvence v poli 1 T | 8,5778 |
| Rozsah chemických posunů | -100 až +4100 ppm |
| Jaderný magnetický moment | +2,813273 |
| Jaderný kvadrupolární moment/fm2 | -71,0 |
Chemické posuny
Údajů je málo, chemické posuny pro jodid se pohybují okolo 0, pro jodistan okolo +4000 ppm.[6]
Interakční konstanty
| Interakce | Sloučenina | Interakční konstanta [Hz] |
|---|---|---|
| 19F-127I | IF6+ | 2730 |
| 19F-127I | IF7 | 2100 |
| 13C-127I | CH3I | <60 |
| 17O-127I | IO4– | 489 |
| 129Sn-127I | SnI4 | 940 |
| 129Sn-127I | SnClI3 | 1097 |
| 129Sn-127I | SnCl3I | 1638 |
Odkazy
- Jod na české wikipedii
- Jod na anglické wikipedii
- 127I NMR
- Crystal structures of the triiodide salt-molecule complexes (Xanthotoxin)2 · KI3 and (Glycine)4 – KI3
- N. N. Greenwood – A. Earnshaw, “Chemie prvků“ 2. díl, 1. vydání 1993 ISBN 80-85427-38-9. s. 1051-1081
- Characterization of organic iodides with iodine-127 nuclear magnetic resonance spectroscopy
Navigace
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| H | He | ||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr |
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe |
| Cs | Ba | La | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| Fr | Ra | Ac | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |
| Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu |
| Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr |

One Reply to “Jod”