Rtuť, Hg, je toxický, těžký, kapalný kov s velmi dobrou tepelnou a elektrickou vodivostí. Je základní složkou amalgámů (slitiny kovů s rtutí), využívá se v teploměrech a barometrech a v elektronice, např. v rtuťových spínačích.
| Atomové číslo | 80 | Počet stabilních izotopů | 6 |
| Atomová hmotnost | 200,59 | Elektronová konfigurace | [Xe] 4f14 5d10 6s2 |
| Teplota tání [°C] | -38,83 | Teplota varu [°C] | 356,73 |
| Elektronegativita | 2,00 | Hustota [g.cm-3] | 13,534 |
Byla prvním kovem, u kterého byla pozorována supravodivost (v roce 1911).
Izotopy
Rtuť se skládá ze sedmi stabilních izotopů, známe dále 40 radioizotopů.
| Izotop | Zastoupení [%] |
| 196Hg | 0,15 |
| 198Hg | 10,0 |
| 198Hg | 16,9 |
| 200Hg | 23,1 |
| 201Hg | 13,2 |
| 202Hg | 29,7 |
| 204Hg | 6,82 |
203Hg
Tento izotop se přeměňuje mechanismem β– na 203Tl, poločas přeměny je 46,59 dne:
$$^{203}_{\ \ 80}\textrm{Hg}\ \rightarrow\ ^{203}_{\ \ 81}\textrm{Tl}\ +\ \beta^-$$
Připravuje se v reaktoru ostřelováním oxidu rtuťnatého neutrony:
$$^{202}_{\ \ 80}\textrm{Hg}\ +\ ^1_0\textrm{n}\rightarrow\ ^{203}_{\ \ 80}\textrm{Hg}\ +\ \gamma$$
Využívá se pro studium chování rtuti v životním prostředí a její interakce s živými organismy.[7]
Výskyt a získávání
Rtuť byla známa již před naším letopočtem, získávala se z cinabaritu (HgS) a hlavním využitím byla extrakce kovů. Byla velmi oblíbená mezi alchymisty, kteří ji využívali převážně pro transmutaci kovů.
Dnes se rtuť získává také z cinabaritu, ale dokonalejšími postupy než v minulosti.
HgS + O2 → Hg + SO2
Chemické vlastnosti
Rtuť nereaguje s neoxidujícími kyselinami, rozpouští se v koncentrované kyselině dusičné a horké, koncentrované kyselině sírové. Produktem jsou rtuťnaté soli. Její elektrodový potenciál je kladný, jako prvek je relativně nereaktivní. Velmi dobře rozpouští kovy, za vzniku slitin (amalgámů), na videu můžete vidět amalgamaci povrchu hliníku.
Mimo rtuťnatých sloučenin tvoří rtuť i sloučeniny ve formálním oxidačním stavu +I, kde je vždy přítomna skupina (Hg-Hg)2+. Nejznámějším zástupcem je kalomel Hg2Cl2. Atomy rtuti jsou spojeny jednoduchou vazbou, která je tvořena překryvem orbitalů 6s. Známe i další případy polykationtů rtuti, např. oxidací kovové rtuti pomocí fluoridu arseničného v kapalném oxidu siřičitém získáme sloučeninu Hg4[AsF6]2, kation Hg42+ je téměř lineární, délka vazby Hg-Hg se pohybuje okolo 260 pm.[4]
Dusičnan rtuťnatý, Hg(NO3)2, se využívá jako činidlo v merkurimetrii.
Thiokyanatan rtuťnatý
Srážením rtuťnatých solí thiokyanatanem draselným získáme bílý thiokyanatan rtuťnatý:
Hg(NO3)2 (aq) + 2 KSCN (aq) → Hg(SCN)2 (s) + 2KNO3 (aq)
Jeho zapálením získáme efekt označovaný jako faraonovi hadi. Při hoření vzniká velké množství plynů a vznikající pevná látka je nadýchaná a připomíná hada. Hoření můžeme popsat rovnicí:
2 Hg(SCN)2 + 5 O2 → 2 HgO + 2 SO2 + 2 CO2 + N2
Ukázku můžete vidět na videu:
Sonochemickou reakcí kovové rtuti s redukovaným grafenoxidem ve vodě se povedlo připravit kompozitní materiál, který je za laboratorní teploty pevný.
Polykationty rtuti
Rtuť vytváří větší množství kationtů s vazbou Hg–Hg, nejznámější je rtuťný kation, Hg22+, který najdeme např. v kalomelu (Hg2Cl2).[5]
Známe i další polykationty rtuti, např. Hg32+ a Hg42+. První získáme reakcí komproporcionační reakcí rtuti a chloridu rtuťnatého s chloridem hlinitým:
2 Hg + HgCl2 + AlCl3 → Hg3[AlCl4]2
Oxidací rtuti pomocí fluoridu arseničného získáme kation se čtyřmi atomy rtuti:[4]
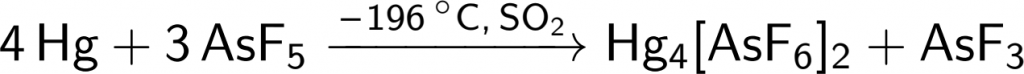
| Kation | Délka vazby Hg–Hg [pm] |
| Hg22+ | 249–256 |
| Hg32+ | 251–255 |
| Hg42+ | 259–267 |
Organokovové sloučeniny
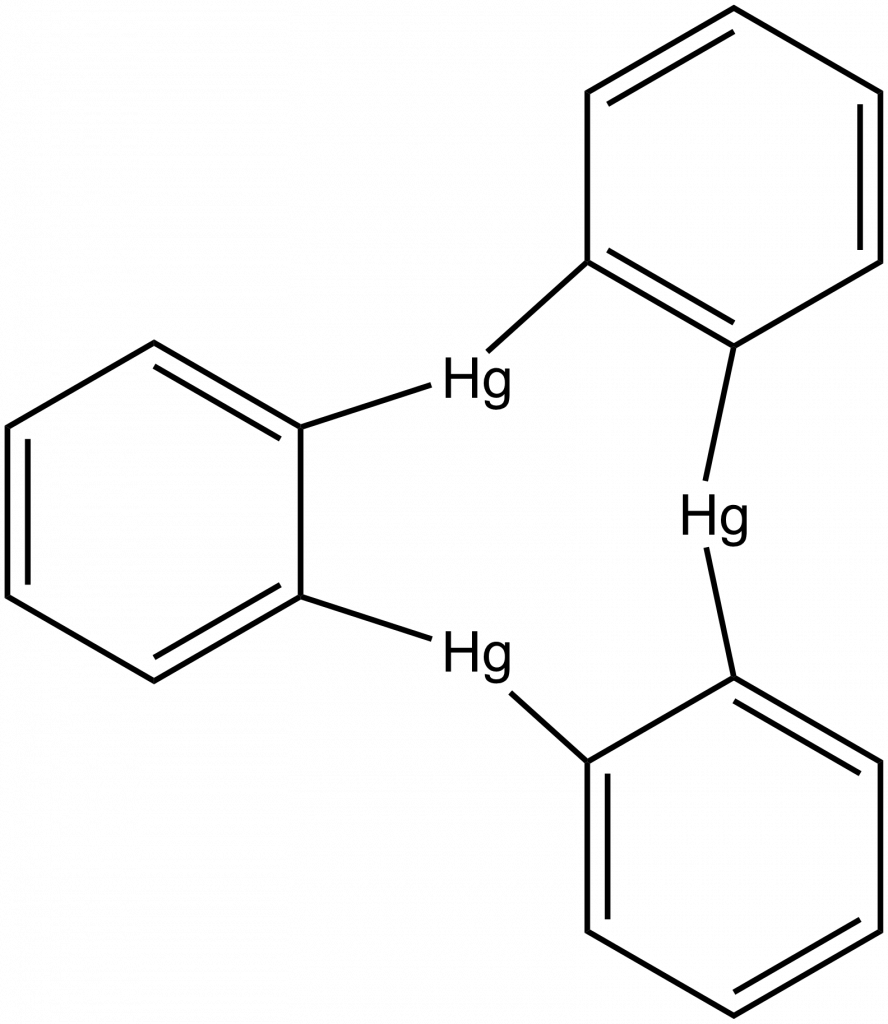
Organokovové sloučeniny rtuti jsou zpravidla silně toxické, RHgX jsou krystalické látky, R2Hg jsou kapaliny nebo nízkotající látky. Zajímavou strukturu má o-fenylhydrargium, které vytváří trimerní molekuly, viz obrázek dole.
Využití
Kovová rtuť je kapalný vodič, to určuje jeden směr jejího využití. I v dnešní době se můžeme potkat s rtuťovými spínači, ty umožňují spínání a rozepínání obvodu v závislosti na poloze spínače. Historicky byly důležité rtuťové usměrňovače, které umožňovaly usměrňování vysokých napětí (až 150 kV) a proudů (až 10 kA) ještě před objevem polovodičových prvků.


S rtutí se můžeme potkat i v (nejen) laboratorních barometrech, i když se od jejich používání pomalu upouští. Díky nim máme i jednu jednotku tlaku, mm Hg sloupce. Atmosférickému tlaku odpovídá 760 mm Hg sloupce.

NMR
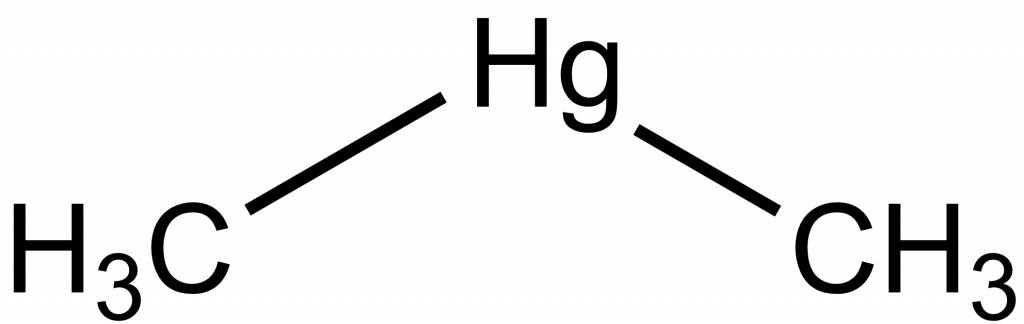
Rtuť má celkem sedm stabilních izotopů, dva z nich jsou NMR aktivní. Pro měření je výhodnější jádro 199Hg, 201Hg je kvadrupolární a poskytuje velmi široké signály. Obě jádra jsou málo citlivá. Standardem je roztok Me2Hg. Interakční konstanta 1J199Hg,13C = 686,2 Hz pro Me2Hg. Dimethylrtuť je ovšem velmi jedovatá a je s ní potřeba zacházet velmi opatrně! Jako alternativní standard lze využít chloristan nebo chlorid rtuťnatý.[6]
| 199Hg | 201Hg | |
| Spin | 1/2 | 3/2 |
| Zastoupení v přírodě [%] | 16,9 % | 13,2 % |
| Rozsah chemických posunů | -3000 – 500 ppm | |
| Citlivost vzhledem k 1H | 1,00.10-3 | 1,97.10-4 |
| Citlivost vzhledem k 13C | 5,89 | 1,16 |
| Rezonanční frekvence v poli 1 T | 16,87 | 13,18 |
| Jaderný magnetický moment | +0,5058855 | -0,5602257 |
Chemické posuny
| Organortuťnaté sloučeniny | 500 – -1500 | HgCl2 | -1500 |
| HgBr2 | -2000 | Hg(NO3)2 | -2500 |
| HgI2 | -3000 |
Odkazy
- Rtuť na české wikipedii
- Rtuť na anglické wikipedii
- Hg NMR
- Preparation and crystal structure of tetramercury bis(hexafluoroarsenate) Hg4(AsF6)2
- On formation of polyatomic mercury cations
- Chemical Shift Standards for 199Hg NMR Spectroscopy, Twenty-Five Years Later
- Absorption and disposition of 203Hg in the pregnant and nonpregnant hamster following oral administration of [203Hg]methylmercuric chloride
Navigace
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| H | He | ||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr |
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe |
| Cs | Ba | La | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| Fr | Ra | Ac | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |
| Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu |
| Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr |
3 Replies to “Rtuť”