Germanium je tvrdý, šedobílý polokov, který nachází využití v polovodičovém průmyslu. Jedná se o vzácný prvek, ale ve stopových množstvích se vyskytuje v řadě minerálů. Je reaktivnější a elektropozitivnější než křemík.
| Protonové číslo | 32 | Elektronová konfigurace | [Ar] 3d10 4s2 4p2 |
|---|---|---|---|
| Elektronegativita | 2,01 | Počet stabilních izotopů | 5 |
| Teplota tání | 945 °C | Teplota varu | 2850 °C |
Historie
Existenci germania předpověděl již roku 1869 Dmitrij Mendělejev, který se snažil předpovědět vlastnosti dosud neznámých prvků a mezeru mezi křemíkem a cínem v tehdejší verzi PSP vyplnil prvkem, který nazval podle jeho polohy Ekasilicon. Izolováno a identifikováno bylo roku 1886 Clemensem Winklerem z minerálu argyroditu.
Izotopy
V přírodě se vyskytuje jako směs pěti izotopů (70, 72, 73, 74 a 76), z nichž je pouze jeden aktivní v NMR (73). Dále známe 27 radioizotopů.
| Izotop | Zastoupení [%] |
|---|---|
| 70Ge | 20,57 |
| 72Ge | 27,45 |
| 73Ge | 7,75 |
| 74Ge | 36,50 |
| 76Ge | 7,73 |
76Ge
Bylo zjištěno, že izotop 76Ge není stabilní, ale rozpadá se dvojitou přeměnou beta s velmi dlouhým poločasem 1,78 . 1021 let.[7]
$$^{76}_{32}\textrm{Ge}\ \rightarrow\ ^{76}_{34}\textrm{Se}\ +\ 2\ ^{\ \ 0}_{-1}\beta$$
77Ge
Přeměňuje se mechanismem beta mínus s poločasem 11,30 hodin:
$$^{77}_{32}\textrm{Ge}\ \rightarrow\ ^{77}_{33}\textrm{Se}\ +\ ^{\ \ 0}_{-1}\beta$$
Tento izotop lze využít ke sledování toků produktů v ropném průmyslu, k tomuto se používají značené tetraalkylsloučeniny germania, např. tetraethylgermanium, 77Ge(C2H5)4.[8]
Chemické vlastnosti
Germanium reaguje s koncentrovanou kyselinou dusičnou za vzniku GeO2, mechanismus reakce je poměrně složitý.[4] V roztocích zásad se nerozpouští. S HCl reaguje za vzniku GeCl4 a s H2S poskytuje GeS2.
Sloučeniny germania
S vodíkem vytváří mnoho binárních hydridů, mají obecný vzorec GenH2n+2, známé jsou pro hodnoty n od 1 do 9. Jejich struktura může být jak lineární, tak rozvětvená. German, GeH4, je méně reaktivní než silan (SiH4), je to bezbarvý, ve vodě nerozpustný plyn. Lze jej vyrobit reakcí oxidu germaničitého s tetrahydridoboritanem sodným, touto reakcí, ale vznikají i vyšší germany.
GeO2 + NaBH4 → GeH4 + NaBO2
Oxid germaničitý, GeO2, je bílá pevná látka, která se rozpouští v kyselinách i zásadách. Lze jej připravit jak krystalický, tak i amorfní. Krystalický vytváří dvě hlavní polymorfní modifikace – hexagonální (struktura β-křemene) a tetragonální (struktura rutilu). Využívá se pro přípravy speciálních, optických skel, a také jako polovodivý materiál.
Jeho zahříváním s kovovým germaniem na teplotu 1000 °C vzniká GeO, který z reakční směsi sublimuje. Jde o amorfní látku, která po rozpuštění v kyselinách poskytuje příslušné soli GeII a v zásadách pak trihydroxogermanaté ionty (Ge(OH)3–).
Sulfid germaničitý je bílá, krystalická látka, jeho struktura je polymerní. Sulfid germanatý je červenohnědý prášek, vyrábí se redukcí GeS2 kyselinou fosfornou. Využívá se jako polovodivý materiál a jako chalkogenidové sklo.[6]
Halogenidy
Halogenidy germania jsou v mnohém podobné halogenidům křemíku, jejich základní vlastnosti jsou shrnuty v tabulce.
| Sloučenina | Vzhled | Teplota varu [°C] | Teplota tání [°C] |
|---|---|---|---|
| GeF4 | bezbarvý plyn | −36,5 | −15 |
| GeF2 | bílé, hygroskopické krystaly | 130 (sublimuje) | 110 |
| GeCl4 | bezbarvá kapalina | 86,5 | −49,5 |
| GeCl2 | pevná látka | – | – |
| GeBr4 | pevná látka | – | 24 |
| GeI2 | žlutá krystalická látka | – | – |
| GeI4 | oranžovo-červená krystalická látka | 440 (rozklad) | 144 |
GeX4 lze připravit přímou syntézou z prvků nebo reakcí halogenvodíku s oxidem germaničitým. GeX2 se připravují reakcí GeX4 s kovovým germaniem, jsou stabilní, ale při zahřívání disproporcionují:
GeX2 → GeX4 + Ge
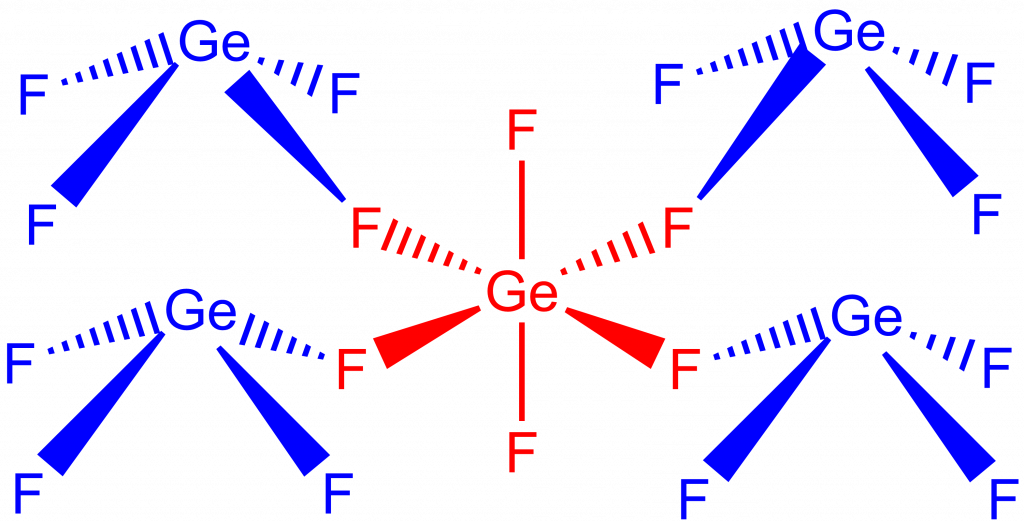
Zajímavým halogenidem je komplex Ge5F12, který obsahuje germanium v oxidačním stavu IV i II. Můžeme ho popsat vzorcem [(GeF2)4GeF4]. Je to polymerní systém skládající se ze čtvercových bipyramid GeF6 propojených deformovanými čtvercovými pyramidami {|GeIIF4}, nevazebný elektronový pár je orientován opačným směrem než fluoridy, viz. obrázek dole.
Organokovové sloučeniny germania jsou podobné sloučeninám křemíku, ale jsou reaktivnější. Organogermany lze využít při Sakuraiově reakci:
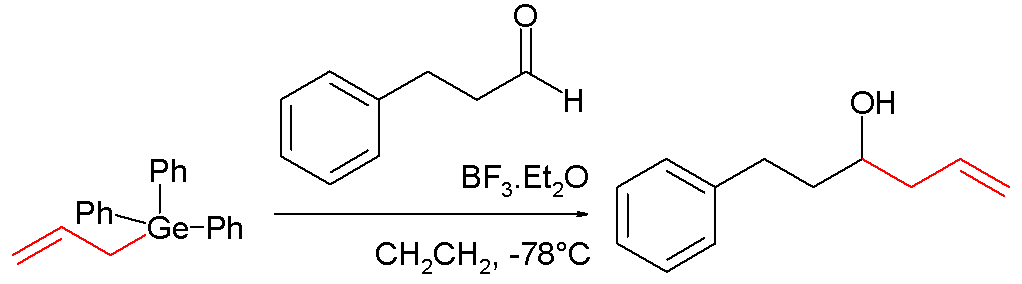
S kovy germanium binární sloučeniny netvoří, ale vytváří složitější klastry, které se označují jako Zintlovy fáze.
NMR
73Ge
Jádro je málo citlivé, spektra jsou široká, proto je použitelné hlavně pro symetrické molekuly. Velkým problémem při měření je tzv. ringing sondy, který deformuje baselinu spektra. Tento problém se dá vyřešit použitím složitějších pulsních sekvencí, např. RIDE nebo EXSPEC.
| Spin | 3/2 |
|---|---|
| Výskyt v přírodě | 7,73 % |
| Rezonanční frekvence v poli 1 T | 1,4897 |
| Rozsah chemických posunů | 160 – (-1110) |
| Citlivost vůči 1H | 1,09.10-4 |
| Citlivost vůči 13C | 0,642 |
| Jaderný magnetický moment | -0,8794677 |
Chemické posuny
| Sloučenina | Chemický posun [ppm] |
| Me4Ge (primární standard) | 0 |
| Me3GeH | –56,9 |
| Me2GeH2 | –127,6 |
| MeGeH3 | –209,2 |
| GeH4 | –299 |
| Ph4Ge | –31,6 |
| Ph3GeH | –56,0 |
| Ph2GeH2 | –108,5 |
| PhGeH3 | –187,5 |
| MesGeH3 | –234,3 |
| Ge(OMe)4 | –37,8 |
| Ge(OnBu)4 | –45,6 |
| Ge2H6 | –312 |
| Ge4H10 | –284 a –300 |
| Ge2Ph6 | –59 |
| GeCl4 | 31 |
| GeCl2Br2 | –130 |
| GeBr4 | –312 |
| GeI4 | –1086 |
| GeCl4(bpy) | –313,7 |
Hodnota interakční konstanty 1JGe-H se pohybuje v rozmezí 85-100 Hz.
Odkazy
- Germanium na české wikipedii
- Germanium na anglické wikipedii
- 73Ge NMR
- Avoyan, A.; Tindall, C.; Hemminger, J.C. J. Phys. Chem. B, 1999, 102, 5096-5076. DOI: 10.1021/jp9726347. Chemistry of HNO3 on Ge(100).
- Charles S. Weinert, “ Nuclear Magnetic Resonance Spectroscopy of Germanium Compounds,” ISRN Spectroscopy, vol. 2012, Article ID 718050, 18 pages, 2012. doi:10.5402/2012/718050
- GeS (Germanium sulfide)
- Results of the experiment on investigation of Germanium-76 double beta decay
- Use of Germanium Organic Compounds Labelled with Germanium-77 to Investigate the Behaviour of Petroleum Products in Refining Installations
Navigace
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| H | He | ||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr |
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe |
| Cs | Ba | La | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| Fr | Ra | Ac | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |
| Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu |
| Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr |
One Reply to “Germanium”