Xenon je bezbarvý plyn, bez chuti a zápachu. Patří mezi vzácné plyny. Tvoří pouze několik málo sloučenin s fluorem, chlorem a kyslíkem. Xenon byl objeven roku 1889 během frakční destilace zkapalněného vzduchu.
| Atomové číslo | 54 | Elektronová konfigurace | [Kr] 4d10 5s2 5p6 |
|---|---|---|---|
| Počet přírodních izotopů | 9 | Atomová hmotnost | 131,29 |
| Obsah ve vzduchu [ppm] | 0.087 | Hustota | 5,8971 kg.m-3 |
| Teplota tání | -111,8 °C | Teplota varu | -108,13 °C |
Izotopy xenonu
Přírodní xenon se skládá ze sedmi stabilních izotopů a dvou radioizotopů.
| Izotop | Zastoupení [%] | Poločas přeměny |
| 124Xe | 0,095 | 1,8×1022 let |
| 126Xe | 0,0890 | stabilní |
| 128Xe | 1,91 | stabilní |
| 129Xe | 26,4 | stabilní |
| 130Xe | 4,07 | stabilní |
| 131Xe | 21,2 | stabilní |
| 132Xe | 26,9 | stabilní |
| 134Xe | 10,4 | stabilní |
| 136Xe | 8,86 | 2,165×1021 let |
133Xe
Poločas přeměny je 5,243 dne, mechanismem β- se mění na 133Cs:
$$^{133}_{\ \ 54}\textrm{Xe}\ \rightarrow\ ^{133}_{\ \ 55}\textrm{Cs} + ^{\ \ \ 0}_{-1}\beta^-$$
Získává se ozařováním uranu obohacenému izotopem 235U, ozářený uran se rozpustí v kyselině dusičné, uvolněné plyny jsou pročištěny a vysušeny pomocí molekulové síta. Xenon se následně sorbuje na aktivní uhlí.
Využívá se v nukleární medicíně pro vyšetření plic, pacient vdechuje vzduch s přídavkem 133Xe. Průběžně jsou pořizovány snímky plic, oblasti, kde je nízká koncentrace xenonu jsou oblasti, kde je špatný přístup vzduchu. Dále ho lze využít ke sledování proudění krve.
Chemické vlastnosti
První sloučenina xenonu byla připravena v roce 1962 N. Bartlettem, který se původně zabýval chemií PtF6. Během jednoho experimentu došlo k neplánovanému průniku vzduchu do reaktoru a náhlé změně barvy. Vzniklá sloučenina byla charakterizována jako O2PtF6. Na základě této reakce se PtF6 projevil jako velmi silné oxidační činidlo, proto Bartlett provedl i experiment s xenonem. Během reakce došlo vyloučení tmavě žluté pevné látky XePtF6, tím začal výzkum chemie xenonu.[5]
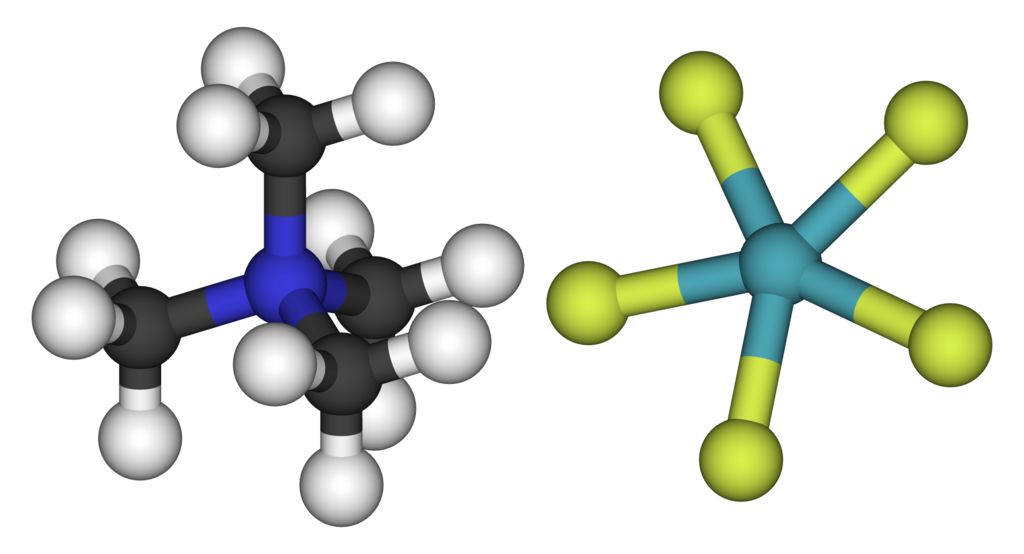
V roce 1991 byla popsána příprava sloučenin s aniontem XeF5–, který byl první popsanou částicí AX5 s planární geometrií.[7]
Halogenidy
Fluorid xenonatý, XeF2, může být připraven zahříváním xenonu s fluorem na teplotu 400 °C v niklovém reaktoru nebo výhodněji ozařováním této směsi slunečním světlem. Jde o bílou, krystalickou látku, která sestává s paralelních, lineární jednotek. Je to nejstabilnější, známá sloučenina xenonu. Jeho struktura odpovídá teorii VSEPR. Tři volné elektronové páry obsazují ekvatoriální pozice trojboké bipyramidy a vazby Xe-F obsazují axiální pozice. Úhel F-Xe-F je 180°.
Využívá se jako výhodné fluorační činidlo s oxidačními účinky. Příkladem může být fluorace Ph3TeF, která probíhá v chloroformu za laboratorní teploty:[15]
Ph3TeF + XeF2 → Ph3TeF3 + Xe
Lze dokonce připravit jeho vodný roztok, který je při 0 °C poměrně stabilní. Poločas rozkladu je cca 7 hodin. Tento roztok má velice silné oxidační vlastnosti, dokáže oxidovat např. chloridy na elementární chlor a chromité soli na chromany.
Fluorid xenoničitý, XeF4, můžeme připravit zahříváním směsi xenonu s fluorem na teplotu 400 °C za tlaku 0,6 MPa. Podobně jako fluorid xenonatý jde o pevnou, krystalickou látku. Molekula má v pevném i plynném stavu čtvercový tvar. Je to také velmi silné fluorační činidlo:
2 Hg + XeF4 → 2 HgF2 + Xe
Pt + XeF4 → PtF4 + Xe
Hydrolýzou vzniká oxid xenonový:
6 XeF4 + 12 H2O → 2 XeO3 + 4 Xe + 3 O2 + 24 HF
Sloučeniny s kyslíkem
V roce 2015 byla publikována příprava sloučeniny obsahující dikation [XeOXeOXe]2+.[9]
Využití
Xenon se využívá ve výbojkách, kde je jeho světlo fialové až modré, ty mají baktericidní účinky, proto se využívají v desinfekci. Využívá se i v xenonovém iontovém pohonném systému, např. v sondě Deep Space 1.
Detekce temné hmoty
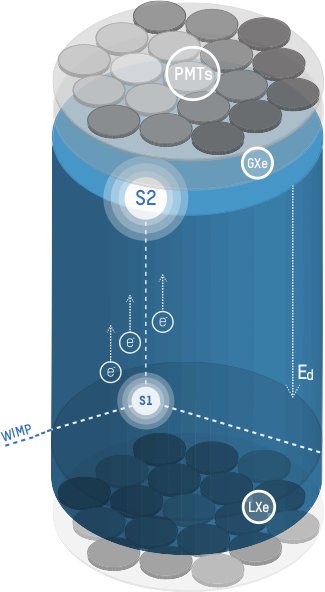
Xenon se využívá v několika projektech hledajících známky temné hmoty.[14] V detektorech se využívá superčistý kapalný xenon, který při interakci s částicemi poskytuje fotony ultrafialového záření o vlnové délce 178 nm. Foton je pak zachycen a zesílen pomocí pole fotonásobičů.
Nejnovější projekt XENON1T, který začal v roce 2014 se skládá z 3,2 tuny kapalného xenonu a je umístěn hluboko pod vápencovým masivem v Abruzských Apeninách ve střední Itálii. V současné době je upgradován na novou a výkonnější variantu XENONnT, který bude obsahovat více než 8 tun xenonu.
Xenonové NMR
Xenon má dva NMR aktivní izotopy se střední citlivostí a velkým rozsahem chemických posunů. 131Xe má spin 3/2, střední citlivost a poskytuje spektra s širokými signály. 129Xe má spin 1/2 a střední citlivost, proto je využíváno častěji, poskytuje podstatně užší linie.
| 129Xe | 131Xe | |
|---|---|---|
| Spin | 1/2 | 3/2 |
| Zastoupení v přírodě [%] | 26,44 | 21,18 |
| Rozsah chemických posunů | -5200 – +100 | |
| Citlivost vzhledem k 1H | 5,72×10-3 | 5,96×10-4 |
| Citlivost vzhledem k 13C | 33,6 | 3,5 |
| Rezonanční frekvence v poli 1 T | 8,5778 | 11,8604 |
Chemické posuny
| XeOF4 | 0 | Xe(g) | 10-(-50) |
|---|---|---|---|
| Roztoky xenonu | -30-(-300) | Endohedrální fullereny | -100-(-250) |
| Anionty endohedrálních fullerenů | -70-(-300) | Borofluoridy alkylxenonu | -3300-(-4200) |
Xenon je velmi citlivý na chemické okolí, díky jeho silně polarizovatelnému elektronovému obalu dochází k výrazné změně chemického posunu v závislosti na rozpouštědle.[6]
| Rozpouštědlo | Posun [ppm] | Rozpouštědlo | Posun [ppm] |
|---|---|---|---|
| Methanol | -148 | Voda | -196 |
| Methylchlorid | -153 | Diethylether | -160 |
| n-Pentan | -156 | Aceton | -175 |
| n-Heptan | -168 | n-Oktan | -171 |
| Chloroform | -217 | Bromoform | -285 |
| Sirouhlík | -225 | Dijodmethan | -335 |
Využití Xe NMR
129Xe NMR lze využít ke studiu porozity fosforečnanů vzácných kovů (La, Lu, Sm a Yb). Tato metoda byla publikována v roce 2022, viz odkaz 16.
Odkazy
- Xenon na české wikipedii
- Xenon na anglické wikipedii
- Xenon NMR
- Ab initio studies of the nuclear magnetic resonance chemical shifts of a rare gas atom in a zeolite
- Bartlett, N Proc. Chem. Soc. 1962, 6, 218. „Xenon hexafluoroplatinate (V) Xe+[PtF6]−„. doi:10.1039/PS9620000197
- Miller, K.W.; Reo, N.V.; Uiterkamp, A.J.S.; Stengle, D.P.; Stengle, T.R.; Williamson, K.L.; Proc Natl Acad Sci U S A 1981, 78, 4946-4949. Xenon NMR: chemical shifts of a general anesthetic in common solvents, proteins, and membranes.
- Christe, K.O.; Curtis, E.C.; Dixon, D.A.; Mercier, H.P.; Sanders, J.C.P.; Schrobilgen, G.J. J. Am. Chem. Soc. 1991, 113, 3351-3361. „The pentafluoroxenate(IV) anion, XeF5-: the first example of a pentagonal planar AX5 species“. DOI: 10.1021/ja00009a021
- Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements. Oxford: Pergamon Press. ISBN 0-7506-3365-4.
- Nový dikation xenonu
- 129Xenon NMR: Review of Recent Insights into Porous Materials
- ‘Disruptive Device’ Brings Xenon-NMR to Fragile Materials
- Krystalová struktura XeO3
- Stable Chloro- and Bromoxenate Cage Anions; [X3(XeO3)3]3– and [X4(XeO3)4]4– (X = Cl or Br)
- XENON – projekty na výzkum temné hmoty
- Crystal and molecular structures of mer-trifluorotriphenyltellurium and stereoselective fluorine exchange in the mer-trifluorotriphenyltellurium-difluorotriphenyltellurium(1+) system
- 129Xe NMR analysis of pore structures and adsorption phenomena in rare-earth element phosphates
Navigace
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| H | He | ||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr |
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe |
| Cs | Ba | La | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| Fr | Ra | Ac | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |
| Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu |
| Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr |
7 Replies to “Xenon”