Kyslík je plynný chemický prvek, je to nejrozšířenější prvek na zemi, vyskytuje se jak ve volné formě, tak i vázaný. Tvoří tři stabilní izotopy, z nichž pouze jeden je NMR aktivní. V atmosféře ho nacházíme ve formě dikyslíku O2 a ozonu O3. Obrovské množství kyslíku je vázáno ve formě vody (H2O).
| Atomové číslo | 8 | Počet stabilních izotopů | 3 |
| Atomová hmotnost | 15,9994 | Elektronová konfigurace | [He] 2s2 2p4 |
| Teplota tání [°C] | -218,79 | Teplota varu [°C] | -182,95 |
| Elektronegativita | 3,44 | Hustota [kg.m-3] | 1,429 |
Na Zemi je kyslík nejrozšířenějším prvkem, ve vesmíru je ale poměrně vzácný, na 1000 atomů vodíku připadá jen jeden atom kyslíku.

Izotopy
Kyslík má tři stabilní izotopy, nejběžnější je 16O. Známe radioizotopy v rozmezí nukleonových čísel 11-26, nejdelší poločas rozpadu má 15O, 122,3 s.
| Izotop | Zastoupení v přírodě [%] | Jaderný spin |
| 16O | 99,757 | 0 |
| 17O | 0,0038 | 5/2 |
| 18O | 0,0205 | 0 |
Fyzikální vlastnosti
Molekula dikyslíku obsahuje dva nepárové elektrony v protivazebných orbitalech a proto je paramagnetická. To můžeme ověřit chováním kyslíku v přítomnosti silného magnetu, viz video dole:
Přítomnost nepárových elektronů si můžeme dokázat pomocí diagramu molekulových orbitalů:
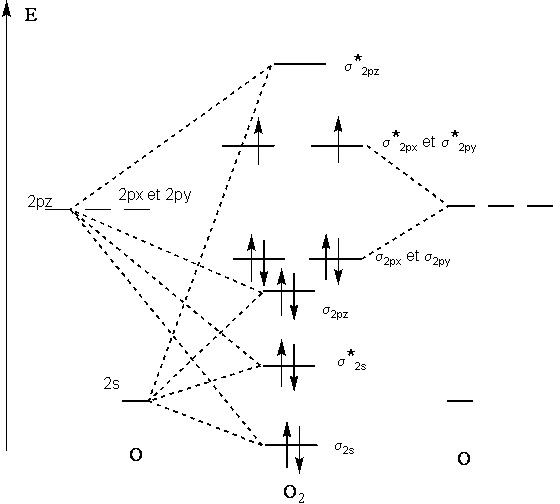
Výroba a příprava
Kyslík (O2) se vyrábí frakční destilací zkapalněného vzduchu, uchovává se a převáží v kapalném stavu. Pro laboratorní výrobu se využívá elektrolýza vody nebo rozklad chlorečnanu, příp. peroxidu vodíku za katalýzy burelem (MnO2).
2 H2O → O2 + 2 H2
2 H2O2 → O2 + 2 H2O
2 KClO3 → 3 O2 + 2 KCl
Chemické vlastnosti
Kyslík je bezbarvý plyn, ale v kapalném stavu je bledě modrý. V elementárním stavu je kyslík silné oxidační činidlo, ale i tak jej lze oxidovat a připravit sloučeniny dioxygenylu.
O2 + PtF6 → O2+[PtF6]–
Ozon
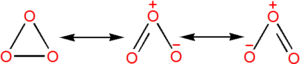
Druhým běžným alotropem kyslíku je ozon, O3, v čistém stavu modrý plyn s charakteristickým zápachem. Jeho molekula má lomený tvar. Vyrábí se působením tichého elektrického výboje na kyslík, za laboratorní teploty je ve vyšších koncentracích nestabilní.
3 O2 → 2 O3
Koncentrovaná kapalina je silně explozivní, v plynném stavu jde o silné oxidační činidlo. Toho se využívá při dezinfekci vody, ozon také dokáže např. oxidovat sulfid na síran.
4 O3 + PbS → PbSO4 + 4 O2
Kyslík je velmi reaktivní, má silné oxidační účinky. Oxidace pomocí kyslíku se nazývá hoření a je často výrazně exotermní. Sloučeniny tvoří nejčastěji v oxidačním stavu -II, ale také -I, I a II a dále v neceločíselných oxidačních stavech.
| -II | Oxidy, soli kyslíkatých kyselin | 1/2 | Dioxygenyl: O2[AsF6] |
| -I | Peroxidy: H2O2, BaO2 | I | Dioxygen difluorid: O2F2 |
| -1/2 | Superoxidy: KO2, CsO2 | II | Oxygen difluorid: OF2 |
| -1/3 | Ozonidy: CsO3, KO3 |
Singletový a tripletový stav kyslíku
Fluoridy kyslíku
Difluorid kyslíku je silně toxická a explosivní sloučenina se vzorce OF2. Je to bezbarvý plyn s teplotou varu −145 °C a teplotou tání −224 °C. Molekula má lomený tvar, úhel FOF je 103° a délka vazby 141 pm. Lze jej připravit reakcí fluoru s hydroxidem sodným:
2 NaOH + 2 F2 → OF2 + 2 NaF + H2O
V čistém stavu ho lze zahřívat téměř do 200 °C, reaguje s velkým množstvím prvků. Působením UV záření disociuje na radikály OF• a F•.
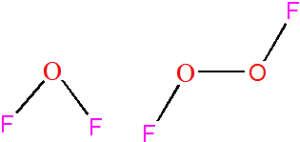
Difluorid dikyslíku je žlutá, pevná látka, která se rozkládá nad teplotou −150 °C. Lze jej připravit působením elektrického výboje na směs kyslíku a fluoru, i za velmi nízkých teplot jde o silné fluorační činidlo, dokáže fluorovat např. SbF5:
2 O2F2 + 2 SbF5 → 2 [O2]+[SbF6]– + F2
Molekula má stejný tvar jako peroxid vodíku, úhel OOF je 109°, délka vazby F-O je 157,5 pm a O-O 122 pm. Délka vazby O-O je kratší než v případě peroxidu vodíku, kde je 147,5 pm.
17O NMR
Standardem pro 17O NMR je voda. Spin jádra je 5/2, díky čemuž jsou linie poměrně široké. Kvůli kvadrupólu jádra a nízkému přirozenému zastoupení je citlivost 17O NMR nízká.
| Spin | 5/2 |
|---|---|
| Zastoupení v přírodě | 0,038 % |
| Jaderný magnetický moment | -1,89379 |
| Rozsah chemických posunů | -40 až 610 ppm (anorganické molekuly) -12 až 1330 ppm (organické molekuly) -12 až 2500 ppm (hemoproteiny) |
| Rezonanční frekvence v poli 1 T | 5,7742 |
| Relativní citlivost k 1H | 1,11×10-5 |
| Relativní citlivost k 13C | 0,0650 |
17O NMR lze použít i pro studium mikroporézních materiálů[7] a biologických systémů.[9]
Chemické posuny
Rozsah 17O chemických posunů je poměrně široký, u biologických systémů může být až -36 – +2500 ppm, menší molekuly se zpravidla vejdou pod +1300 ppm.
| Sloučenina | Rozsah chemických posunů [ppm] |
| Alkoholy | -50 – +70 |
| Ethery | -20 – +90 |
| Acetaly | 10 – 100 |
| Peroxidy | 170 – 280 |
| Sulfoxidy | 0 – 20 |
| (-O’)2SO‘‘2 organické sulfáty | O‘ 85 – 100 O‘‘ 125 – 160 |
| P(OR)3 | 20 – 65 |
| CO32- | 170 – 180 |
| O‘=C(O‘‘R)2 | O‘ 235 – 250 O‘‘ 100 – 115 |
| -COOH | 225 – 250 |
| O‘-(C=O‘‘)2 | O‘ 240 – 255 O‘‘ 375 – 400 |
| -O‘C(R)=O‘‘ | O‘ 100 – 220 O‘‘ 330 – 385 |
| R2N-C=O | 265 – 320 |
| X-C(R)=O (X=F, Cl, Br) | 390 (F) – 550(Br) |
| R2C=O | 545 – 580 |
| R-CH=O | 545 – 625 |
| M-CO (M = kov) | 340 – 400 |
| ClO3– | 260 – 300 |
| ClO4– | 260 – 300 |
| NO32- | 405 – 425 |
| R- NO2 | 410 – 440 |
| -O’-N=O‘‘ | O‘ 460 – 540 O‘‘ 800 – 850 |
| CrO42- | 830 – 850 |
| Cr2O72- | OCr 1080 – 1120 OCr2 325 – 350 (můstkový kyslík) |
Odkazy
- Kyslík na české wikipedii
- Kyslík na anglické wikipedii
- Oxygen NMR
- Direct Measurement of the Mn(II) Hydration State in Metal Complexes and Metalloproteins through 17O NMR Line Widths
- 17O NMR chemical shifts in oxometalates: from the simplest monometallic species to mixed-metal polyoxometalates
- 3.0.CO;2-T“>17O NMR chemical shifts: a simple and useful rule for substituent additivity on oxygen atoms with a coordination number of two
- 17O NMR spectroscopy of crystalline microporous materials
- 17O nuclear magnetic resonance: Recent advances and applications
- 17O Solid-State NMR Spectroscopy of Lipid Membranes
Navigace
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| H | He | ||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr |
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe |
| Cs | Ba | La | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| Fr | Ra | Ac | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |
| Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu |
| Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr |
5 Replies to “Kyslík”