Brom patří mezi halogeny, v elementárním stavu jde o červenohnědou, toxickou kapalinu. Přírodní brom se skládá ze dvou stabilních izotopů, oba jsou NMR aktivní.
| Atomové číslo | 35 | Počet stabilních izotopů | 2 |
| Atomová hmotnost | 79,904 | Elektronová konfigurace | [Ar] 3d10 4s2 4p5 |
| Teplota tání [°C] | -7,35 | Teplota varu [°C] | 58,85 |
| Elektronegativita | 2,96 | Hustota [g.cm-3] | 3,1028 |

Izotopy
Přírodní brom je složen ze dvou stabilních izotopů, 79Br a 81Br. Známe také 32 radioizotopů.
| Izotop | Zastoupení [%] |
| 79Br | 50,7 |
| 81Br | 49,3 |
Historie
Už v Bibli je popsán šarlatový pigment, který římané označovali jako týrský purpur. To je bromovaný derivát indiga, 6,6′-dibromindigo.
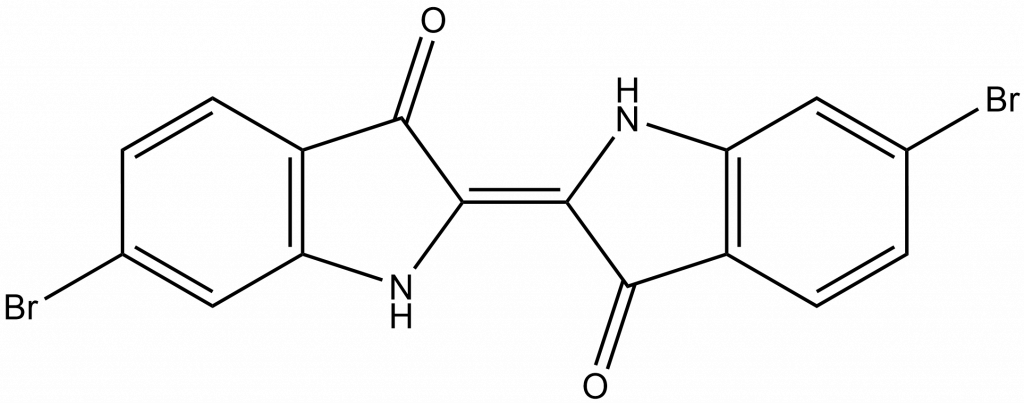
První přípravu bromu provedl Justus von Liebig, který nechal reagovat chlorovou vodu s matečným louhem po odstranění soli z mořské vody. Chlor oxidoval bromid na elementární brom, Liebig, ale produkt neidentifikoval jako nový prvek.
Za objevitele bromu je považován Antoine Jérôme Balard, který jej v roce 1826 izoloval ze slané vody z bažin po krystalizaci síranu a chloridu sodného. Získaný roztok obsahoval velké množství bromidu hořečnatého, který reakcí s chlorovoou vodou poskytl elementární brom:
MgBr2 + Cl2 → MgCl2 + Br2
Výskyt
Brom se v přírodě nevyskytuje v elementárním stavu, pouze ve sloučeninách, největší množství je rozpuštěno v mořské vodě. Celkové zastoupení je poměrně nízké, cca 2-3 ppm.
Nejběžnějším minerálem bromu je bromargyrit, AgBr, ten se vyskytuje na Liberecku a mimo ČR v Německu, Mexiku a Chile.[5,6] Vzácnějším je lafossait. Jde o směsný halogenid thallný Tl(Br,Cl). Ten se vyskytuje v Grónsku a Itálii.[7]
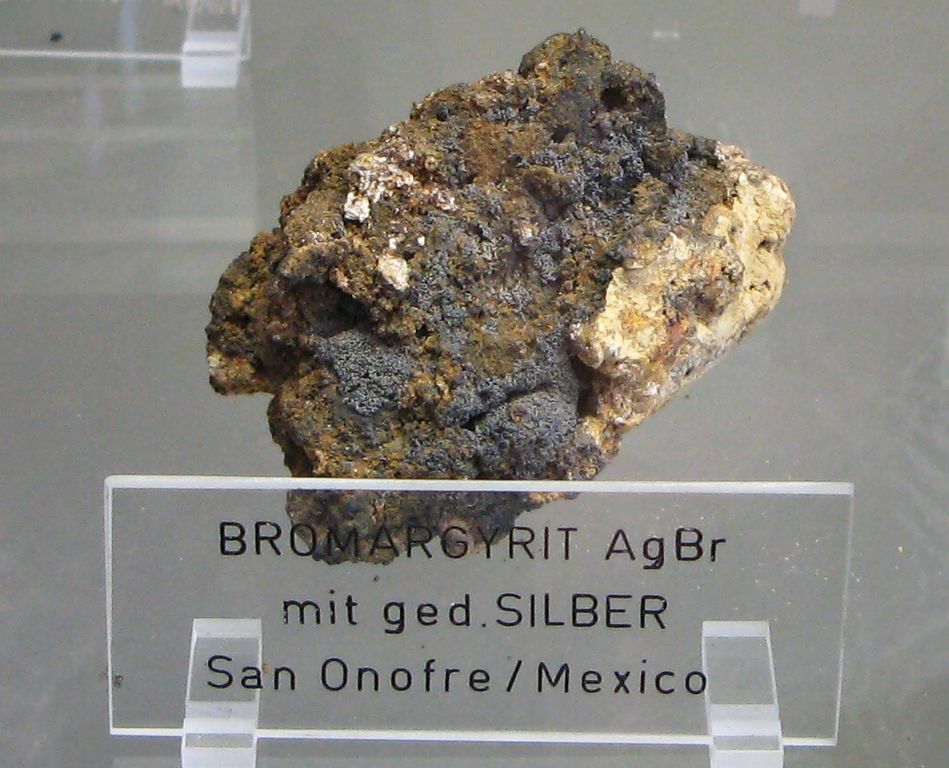
Výroba
Hlavním zdrojem bromu jsou soli rozpuštěné v mořské vodě. Bromidy se oxidují plynným chlorem na brom, který se z roztoku vyhání proudem vzduchu nebo páry. Po kondenzaci je následně přečištěn.
Chemické vlastnosti
Elementární brom má silné oxidační vlastnosti, čehož se často využívá v syntéze. Ve sloučeninách se vyskytuje v mocenstvích -I, +I, +III, +V a +VII.
Oxidy bromu
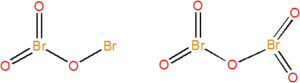
Známe dva nestabilní oxidy bromu, oranžový Br2O3 a bezbarvý Br2O5. Připravují se postupnou oxidací elementárního bromu ozonem (O3). Struktura obou oxidů je na obrázku dole, úhel BrOBr je oxidu bromitého 111° a u oxidu bromičného 121°.
Oxokyseliny bromu
Známe tři oxokyseliny bromu. Kyselinu bromnou HBrO, bromičnou HBrO3 a bromistou HBrO4. Bromistan je mírně silnější oxidační činidlo než chloristan.
Bromičnan draselný se využívá jako základní látka v bromátometrii.
NMR
| 79Br | 81Br | |
|---|---|---|
| Spin | 3/2 | 3/2 |
| Zastoupení v přírodě [%] | 50,69 | 49,31 |
| Rozsah chemických posunů | 100 – -500 ppm | |
| Citlivost vzhledem k 1H | 0,0403 | 0,0491 |
| Rezonanční frekvence v poli 1 T | 10,7042 | 11,5384 |
Standardem je roztok NaBr v D2O (0 ppm). Chemický posun signálu bromidového aniontu se pohybuje v rozmezí +100 – -500 ppm.
Odkazy
- Fluorid bromný – BrF
- Brom na české wikipedii
- Brom na anglické wikipedii
- Bromové NMR
- Bromargyrit
- Bromargyrit na wikipedii
- Lafossait
Navigace
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| H | He | ||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr |
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe |
| Cs | Ba | La | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| Fr | Ra | Ac | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |
| Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu |
| Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr |
One Reply to “Brom”