Chrom, Cr, je kov z 6. skupiny PSP. Je to velmi tvrdý, ale křehký kov. Využívá se jako součást slitin a antikorozní povrchová úprava.
| Atomové číslo | 24 | Počet stabilních izotopů | 3 |
| Atomová hmotnost | 51,9961 | Elektronová konfigurace | [Ar] 3d5 4s1 |
| Teplota tání [°C] | 1906 | Teplota varu [°C] | 2670 |
| Elektronegativita | 1,66 | Hustota [g.cm-3] | 7,15 |
Kovový chrom je za laboratorní teploty poměrně stabilní, ale rozpouští se ve zředěné kyselině chlorovodíkové a sírové. V přírodě se vyskytuje jako součást železných rud. Důležitým minerálem chromu je krokoit PbCrO4. Za laboratorní teploty je antiferomagnetický, jeho Néelova teplota je 38 °C. Nad touto teplotou je paramagnetický.
Využití
Většina chromu se využívá ve slitinách, menší část pak i v chemickém průmyslu.
Slitina Ni-Cr
Slitina 90 % niklu s 10 % chromu se využívá při konstrukci termočlánků.
Sloučeniny
Ve sloučeninách se vyskytuje převážně v oxidačním stavu II, III a VI, přičemž sloučeniny CrVI jsou karcinogenní. Nejstabilnějším oxidačním stavem je III.
Oxidační stav VI
V oxidačním stavu VI se s chromem setkáváme u chromanů a dichromanů.
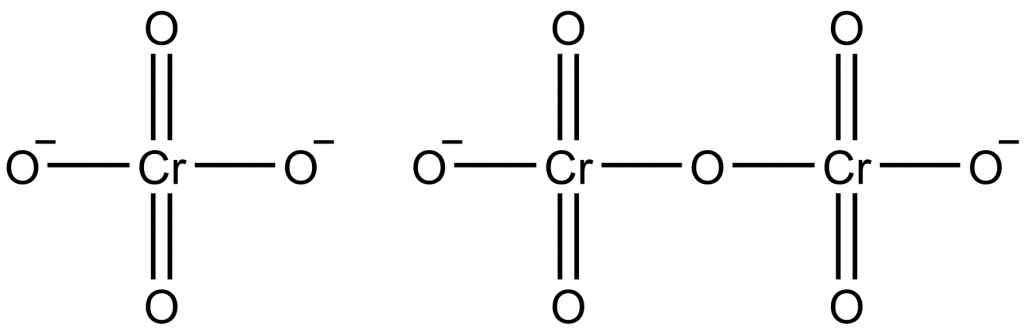
Chromany jsou zpravidla žluté, dichromany pak oranžové. Chroman můžeme na dichroman převést okyselením jeho vodného roztoku, zpět se pak dostaneme přídavkem hydroxidu:
2 K2CrO4 + 2 HCl → K2Cr2O7 + 2 KCl + H2O
K2Cr2O7 + 2 KOH → 2 K2CrO4 + H2O

Dichroman draselný se využívá jako odměrný roztok v bichromatometrii.
Dichroman amonný lze velmi snadno a efektně termicky rozložit za vzniku oxidu chromitého, dusíku a vody. Během této reakce dochází k tzv. vnitřnímu hoření, dichromanový anion je oxidovadlo a amonný kation redukovadlo.
(NH4)2Cr2O7 (s) → Cr2O3 (s) + N2 (g) + 4 H2O (g)
Halogenidy chromylu
Fluorid chromylu, CrO2F2, je fialová, pevná látka. Jeho tavenina je zbarvená do červena. Poprvé byl popsán již roku 1952, kdy byl připraven reakcí oxidu chromového s fluorovodíkem:[6]
CrO3 + 2 HF → CrO2F2 + H2O
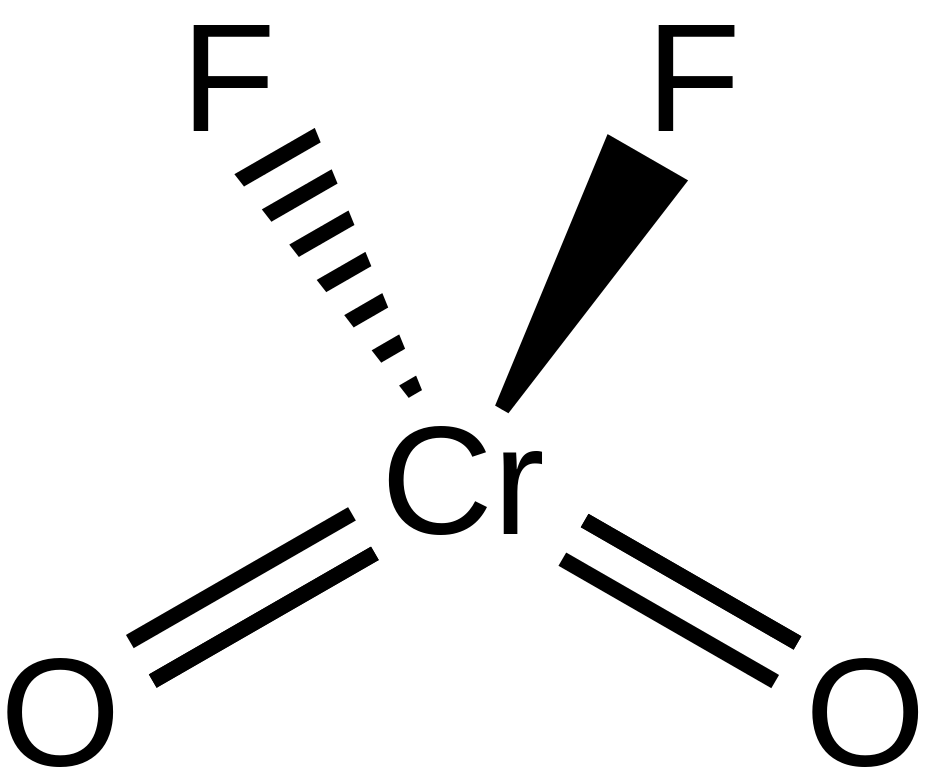
Je to velmi silné oxidační a fluorační činidlo, proto s ním lze manipulovat pouze v plastových lahvích bez obsahu kovů a křemíku:[7]
CrO2F2 + MO → MF2 + CrO3
CrO2F2 + 2 MF → M2[CrO2F4]
Reaguje i s Lewisovými kyselinami, dokáže např. vyvázat organickou kyselinu z jejího anhydridu a vytvořit acylfluorid:[7]
CrO2F2 + 2 (CF3CO)2O → (CF3COO)2CrO2 + 2 CF3COF
Chlorid chromylu, CrO2Cl2, je červenonědá kapalia, kterou můžeme připravit reakcí dichromanu s kyselinou chlorovodíkovou. Tato reakce probíhá v přítomnosti kyseliny sírové jako dehydratačního činidla:[8]
K2Cr2O7 + 6 HCl → 2 CrO2Cl2 + 2 KCl + 3 H2O
nebo oxidu chromového s bezvodým chlorovodíkem:
CrO3 + 2 HCl → CrO2Cl2 + H2O
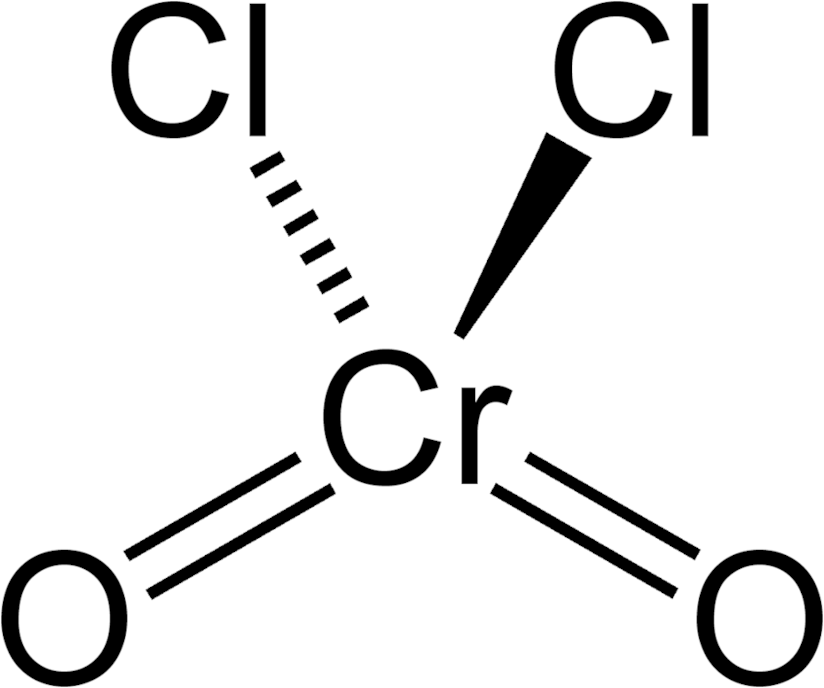

Je to taky silné oxidační činidlo, dokáže např. oxidovat toluen na benzaldehyd, tato reakce se označuje jako Étardova reakce:
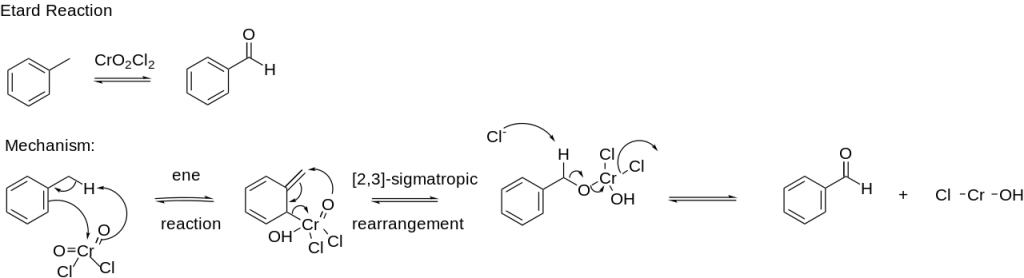
Čtverná vazba
U chromu se setkáváme i s vyššími vazebnými řády. Příkladem sloučeniny se čtvernou vazbou je octan chromnatý. Jedna vazba je typu σ, dvě π a poslední vazba vzniká překryvem všech čtyř laloků d-orbitalů, označuje se jako δ (delta).
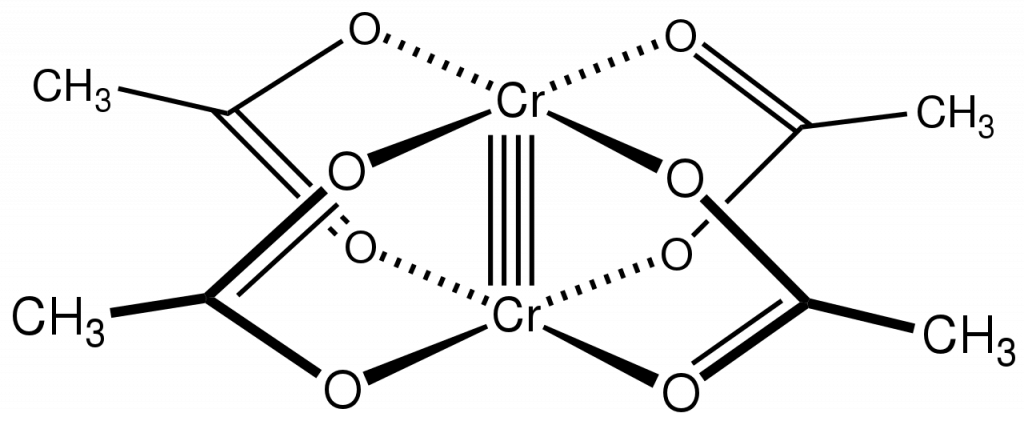
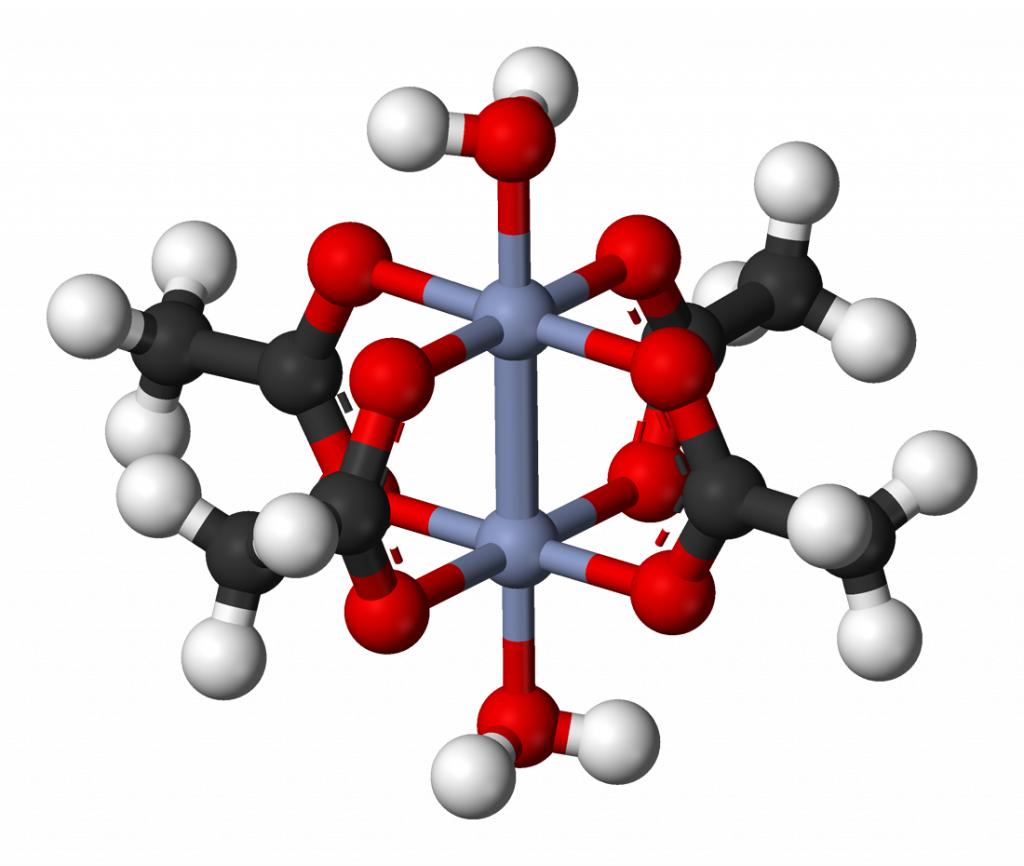
Lze jej připravit redukcí chloridu chromitého zinkem a následným srážením chromnatých iontů octanem:[4]
2 CrCl3 + Zn → 2 CrCl2 + ZnCl2
2 CrCl2 + 4 NaOAc + 2 H2O → Cr2(OAc)4(H2O)2 + 4 NaCl
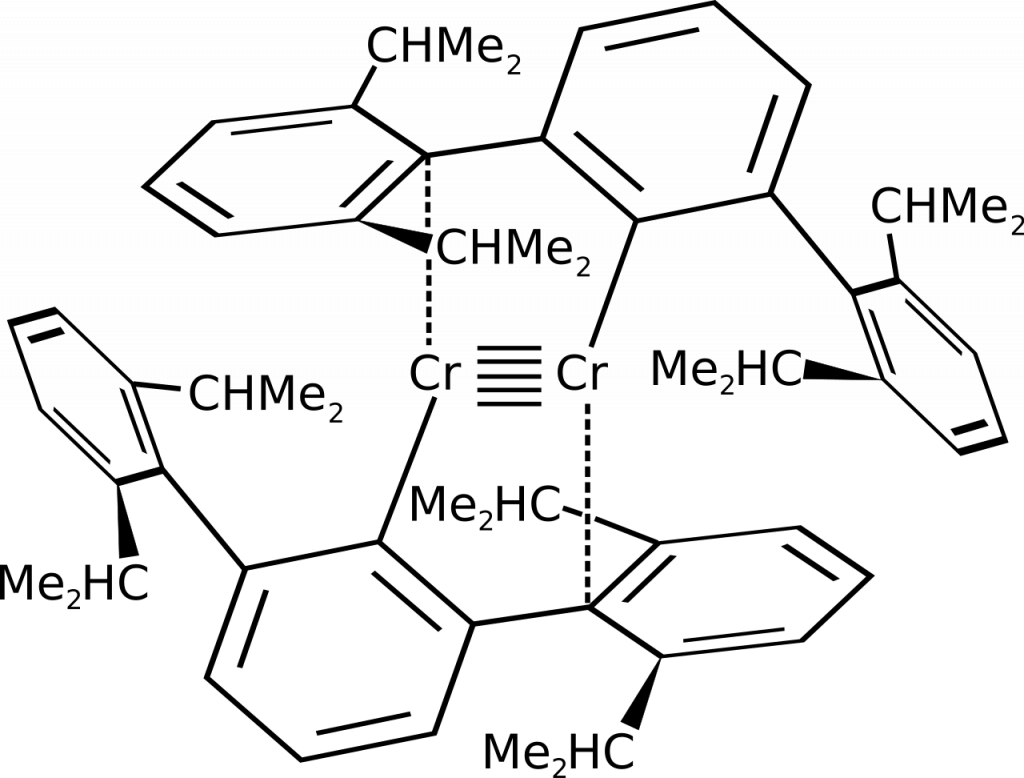
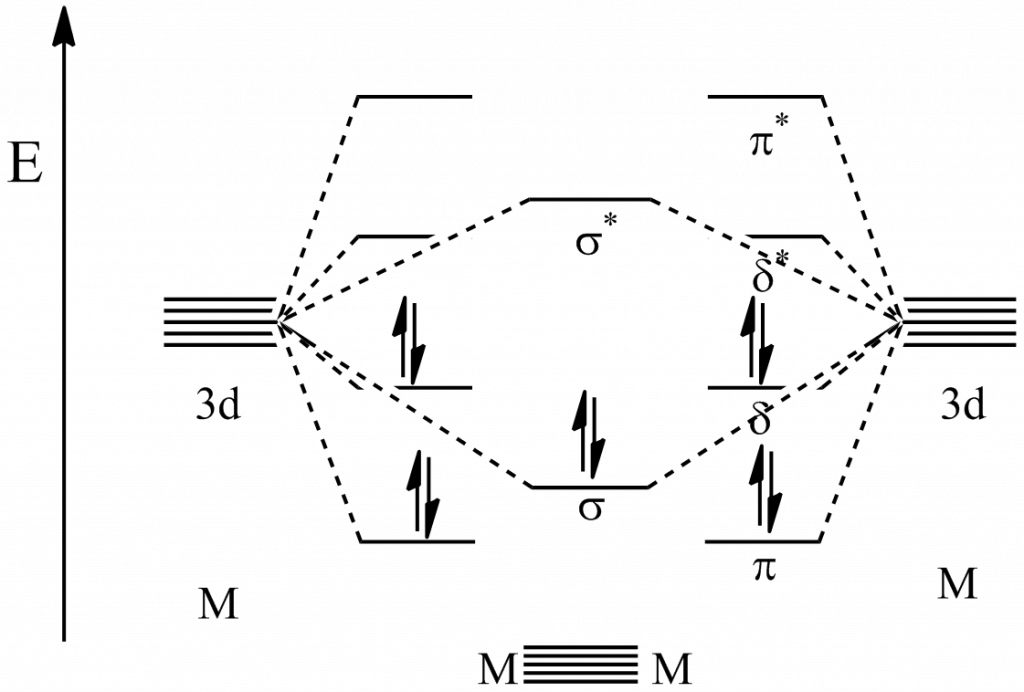
Paterná vazba
Tento typ vazby byl poprvé posán v roce 2005 u sloučeniny chromu připravené redukcí dimerní sloučeniny pomocí draselného interkalátu grafitu. Pro stabilizaci této vazby je nutné použít objemný ligand, např. (2,6-[(2,6-diisopropyl)fenyl]fenyl).[5]
NMR
Chrom má jeden NMR aktivní izotop – 53Cr. Je to kvadrupolární jádro s nízkou citlivostí. Standardem je roztok chromanu v D2O.
| 53Cr | |
| Spin | 3/2 |
| Zastoupení v přírodě [%] | 9,501 % |
| Citlivost vzhledem k 1H | 8,63×10-5 |
| Citlivost vzhledem k 13C | 0,507 |
| Rozsah chemických posunů | -1795 – 0 ppm |
| Rezonanční frekvence v poli 1 T | 2,4115 |
| Jaderný magnetický moment | -0,47454 |
Odkazy
- Chrom na české wikipedii
- Chrom na anglické wikipedii
- 53Cr NMR
- Anyhdrous Chromium(II) Acetate, Chromium(II) Acetate 1-Hydrate, and Bis(2,4-Pentanedionato)Chromium (II)
- ‚Quintuple‘ Bond Makes Its Debut
- Pure Chromyl Fluoride
- The chemistry of chromyl fluoride III. Reactions with inorganic systems
- Chromyl Chloride [Chromium(VI) Dioxychloride]
Navigace
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| H | He | ||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr |
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe |
| Cs | Ba | La | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| Fr | Ra | Ac | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |
| Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu |
| Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr |
One Reply to “Chrom”