Rubidium, Rb, je velmi reaktivní alkalický kov. V přírodě se vyskytuje pouze ve formě rubidných solí, nejčastěji se vyskytuje jako příměs v lepidolitu. Jeho obsah v zemské kůře je 78 ppm. Pojmenováno je podle tmavěčervené barvy, kterou svítí plamen.
| Atomové číslo | 37 | Počet stabilních izotopů | 2 |
| Atomová hmotnost | 85,4678 | Elektronová konfigurace | [Kr] 5s1 |
| Teplota tání [°C] | 39,31 | Teplota varu [°C] | 687,85 |
| Elektronegativita | 0,82 | Hustota [g.cm-3] | 1,532 |

Chemical Elements/Commons
Izotopy
Přírodní rubidium se skládá ze dvou izotopů, jeden je z nich stabilní , 85Rb a druhý má velmi dlouhý poločas rozpadu.[6]
| Izotop | Poločas rozpadu | Zastoupení [%] |
| 85Rb | stabilní | 72,2 |
| 87Rb | 4,81.1010 let | 27,8 |
82Rb
Tento radioaktivní izotop se využívá v pozitronové emisní tomografii (PET). Přeměňuje se na 82Kr, zčásti přeměnou beta plus a zčásti elektronovým záchytem. Poločas přeměny je 1,26 minuty.
Získává se z generátoru 82Sr/82Rb, z něj se eluuje pomocí 0,9% roztoku NaCl. Jelikož má rubidný kation velmi podobný iontový poloměr jako draselný, můžeme jej využít ke studiu pohybu draselného kationtu v organismu. Využívá se např. k diagnostice infarktových stavů i mozkových nádorů.
87Rb
87Rb má velmi dlouhý poločas rozpadu – 4,81.1010 let, využívá se v geochronologii k datování minerálů obsahujících rubidium. Přeměňuje se na 87Sr za uvolnění elektronu (beta minus přeměna).
87Rb → 87Sr + β–
Pomocí rubidia lze datovat minerály, které obsahují alespoň malá množství rubidia. Poměr obou izotopů se zpravidla stanovuje pomocí hmotnostní spektrometrie.
Výroba a využití
Rubidium se vyrábí elektrolýzou taveniny chloridu vápenatého a rubidného, příp. redukcí hydroxidu, příp. oxidu rubidného pomocí hořčíku nebo vápníku. Malé množství rubidia, např. pro laboratorní účely, lze získat termickýcm rozkladem azidu RbN3.
Využívá se ve fotočláncích, katodových trubic a také v zábavné pyrotechnice, kde barví efekty do červena.
Chemické vlastnosti
Vytváří řadu sloučenin s kyslíkem, ve kterých má oxidační číslo I – Rb2O, Rb2O2, Rb4O6, RbO2 a RbO3. Ale také suboxidy, kde je jeho oxidační číslo nižší – Rb6O a Rb9O2.
Komplexní sloučeniny
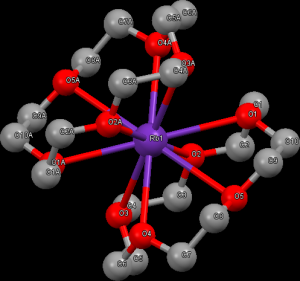
Podobně, jako ostatní alkalické kovy, má i rubidium zajímavou chemii komplexních sloučenin. Důležité komplexy jsou s makrocyklickými ligandy – kryptandy a crownethery, které umožňují rozpuštění iontových sloučenin v organických rozpouštědlech. Příkladem může být komplex rubidia s 21-crown-7 ligandem.
NMR
Rubidium má dva NMR aktivní izotopy, 85Rb a 87Rb, oba jsou kvadrupolární a poskytují široké signály. Využívanější je 87Rb, protože má užší signály. Standardem je 0,01 M roztok RbCl v D2O.
| 85Rb | 87Rb | |
| Spin | 5/2 | 3/2 |
| Zastoupení v přírodě [%] | 72,17 | 27,83 |
| Citlivost vzhledem k 1H | 7,67×10-3 | 0,0493 |
| Citlivost vzhledem k 13C | 45 | 290 |
| Rozsah chemických posunů | −80 – +30 ppm | |
| Rezonanční frekvence v poli 1 T | 4,1254 | 13,9811 |
| Jaderný magnetický moment | +1,35303 | +2,75124 |
Chemické posuny
| Látky | Chemický posun [ppm] |
| Rb+ (aq) | +30 – −80 |
| 1M roztok RbCl v D2O | 8 |
| 0,1M roztok RbCl v D2O | 0 |
| π-komplexy rubidia | +10 – −15 |
Odkazy
- Rubidium na české wikipedii
- Rubidium na anglické wikipedii
- Rubidium NMR
- Butterman, William C.; Brooks, William E.; Reese, Jr., Robert G. (2003). „Mineral Commodity Profile: Rubidium“ (PDF). United States Geological Survey. Retrieved 2010-12-04.
- Strukturen der Alkalimetallsalze aromatischer, heterocyclischer Amide: Synthese und Struktur von Kronenether-Addukten der Alkalimetall-Pyrrolide
- HÁLA, Jiří. Radioaktivní izotopy. Tišnov: Sursum, 2013. ISBN 978-80-7323-248-1. S 150-153
Navigace
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| H | He | ||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr |
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe |
| Cs | Ba | La | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| Fr | Ra | Ac | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |
| Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu |
| Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr |