Kobalt, Co, je namodralý, tvrdý, feromagnetický kov. Využívá se při barvení skla a keramiky a ve slitinách.
| Atomové číslo | 27 | Počet stabilních izotopů | 1 |
| Atomová hmotnost | 58,933195 | Elektronová konfigurace | [Ar] 3d7 4s2 |
| Teplota tání [°C] | 1495 | Teplota varu [°C] | 3100 |
| Elektronegativita | 1,88 | Hustota [g.cm-3] | 8,90 |
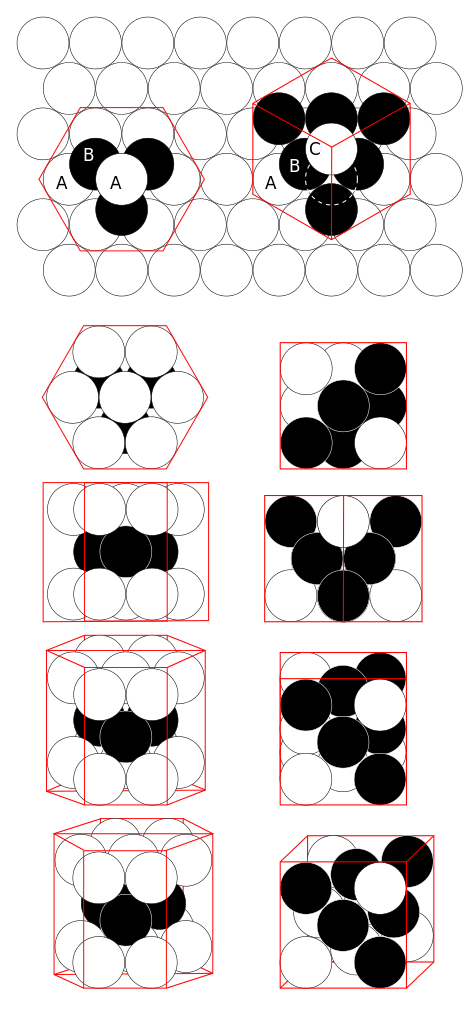
Kobalt existuje ve dvou krystalických modifikacích, α-Co krystaluje v nejtěsnějším hexagonálním uspořádání (HCP), zatímco β-Co krystaluje v plošně centrované kubické mřížce (FCC). Přechod mezi modifikacemi nastává při teplotě 417 °C.
Izotopy
Kobalt je monoizotopický, jediným stabilním izotopem je 59Co. Známe 29 radioizotopů.
| Izotop | Poločas rozpadu |
| 56Co | 77,24 dne |
| 57Co | 274,81 dne |
| 58Co | 70,84 dne |
| 60Co | 5,27 let |
57Co
Připravuje se ozařováním kovového železa deuterony:
$$^{56}_{26}\textrm{Fe}\ +\ ^{2}_{1}\textrm{H}\ \rightarrow\ ^{57}_{27}\textrm{Co}\ +\ \textrm{n}$$
Využívá se v medicíně, např. na značení vitamínu B12. Tak je možné určit příjem vitamínu střevní sorbcí.[6]
60Co
Izotop 60Co je radioizotopem kobaltu s nejdelším poločasem rozpadu. Připravuje se ostřelováním slitiny kobaltu s niklem neutrony v jaderném reaktoru:
$$^{59}_{27}\textrm{Co}\ +\ ^{1}_{0}\textrm{n}\ \rightarrow\ ^{60}_{27}\textrm{Co}$$
Využívá se jako zdroj γ záření, emituje silně pronikavé gamma záření, což umožňuje prozařování i objemnějších předmětů. S kobaltovými zářiči se můžeme potkat v medicíně, kde slouží ke sterilizaci lékařského vybavení. V chemii se využívají izotopicky značené sloučeniny kobalu ke zkoumání průběhu chemických reakcí.
Výskyt
V zemské kůře je jeho koncentrace cca 29 ppm. Doprovází niklové rudy, příp. sulfidické rudy mědi a olova. Nejrozšířenějšími nerosty jsou smaltin CoAs3, linnéit Co3S4 a kobaltit CoAsS. Výroba kovového kobaltu je poměrně složitý proces, protože je nutné odstranit doprovodné kovy (Ni, Cu, Pb, Fe, Bi, As). Poté se oxid kobaltnato-kobaltitý redukuje uhlíkem.
Chemické vlastnosti
Nejběžnějšími oxidačními čísly kobaltu ve sloučeninách jsou II a III. Kobaltitý ion má silné oxidační vlastnosti, oxiduje vodu za vývoje kyslíku, z toho důvodu je známo jen několik málo kobaltitých sloučenin. Naproti tomu je známo velké množství komplexních sloučenin s kationtem CoIII.
Oxidační čísla
| Oxidační stav | Koordinační číslo | Tvar molekuly | Sloučenina |
| -I (d10) | 4 | tetraedr | [Co(CO)4]– |
| 0 (d9) | 4 | tetraedr | [Co(PMe3)4] |
| I (d8) | 5 | trigonální bipyramida | [Co(NCMe)5]+ |
| tetragonální pyramida | [Co(NCPh)5]+ | ||
| 6 | oktaedr | [Co(bipy)3]+ | |
| II (d7) | 2 | lineární | [Co{N(SiMe3)2}2] |
| 3 | trojúhelník | [Co{N(SiMe3)2}2(PPh3)] | |
| 4 | tetraedr | [CoCl4]2- | |
| čtverec | [Co(ftalocyanin)] | ||
| 5 | trigonální bipyramida | [CoBrN(C2H4NMe2)3)]+ | |
| tetragonální pyramida | [Co(CN)5]3- | ||
| 6 | oktaedr | [Co(H2O)6]2+ | |
| 8 | dodekaedr | [Co(NO3)4]2- | |
| III (d6) | 6 | oktaedr | [Co(NH3)6]3+ |
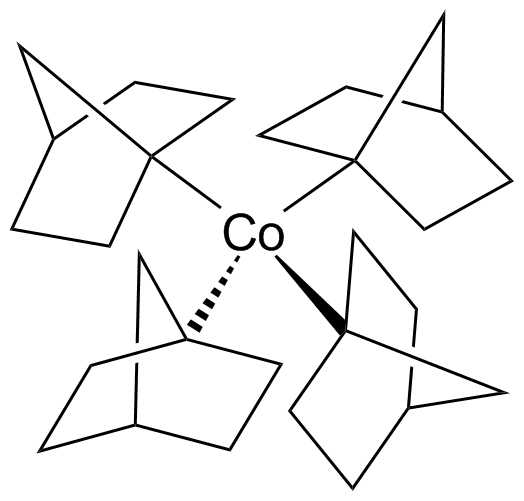
| IV (d5) | 4 | tetraedr | [Co(1-norbornyl)4] |
| 6 | oktaedr | [CoF6]2- |
Oxidy
Známe tři oxidy kobaltu: kobaltnatý (CoO), kobaltitý (Co2O3) a kobaltnato–kobaltitý (Co3O4). Oxid kobaltnatý získáme žíháním hydroxidu, dusičnanu nebo uhličitanu kobaltnatého za nepřístupu vzduchu. Na vzduchu je stabilní i za vysokých teplot. Zahříváním na teplotu 600-700 °C přechází na oxid kobaltnato-kobaltitý, který má spinelovou strukturu.
Halogenidy
| Halogenid | Barva |
| CoF3 | světle hnědý |
| CoF2 | růžový |
| CoCl2 | modrý |
| CoBr2 | zelený |
| CoI2 | modročerný |
Fluorid kobaltitý se využívá jako fluorační činidlo ve Fowlerově procesu.
Barva chloridu kobaltnatého závisí na stupni hydratace. Bezvodý je světle modrý a při hydrataci postupně přechází až na červený hexahydrát.

Bezvodý fluorid kobaltnatý je možné připravit zahříváním chloridu ve fluorovodíku. Bezvodý chlorid a bromid se připravují působením halogenu na zahřátý kobalt, jodid se připravuje působením HI na zahřátý kobalt. Hydratovaný chlorid kobaltnatý je možné snadno vyrobit srážením dusičnanu kobaltnatého sodou a následným rozpuštěním vzniklého uhličitanu pomocí kyseliny chlorovodíkové.
Koordinační sloučeniny
Koordinační sloučeniny kobaltité vynikají barevností, viz tabulka.
| Komplexní ion | Barva |
| [Co(NH3)6]3+ | zlatohnědá |
| [Co(NH3)5(H2O)]3+ | světle červená |
| [Co(NH3)5Cl]2+ | purpurová |
| [Co(NH3)5NO2]2+ | oranžová |
| cis-[Co(NH3)4Cl2]+ | tmavě fialová |
| trans-[Co(NH3)4Cl2]+ | zelená |
| cis-[Co(NH3)4(NO2)2]+ | zlatožlutá |
| trans-[Co(NH3)4(NO2)2]+ | šafránová |
Organokovové sloučeniny
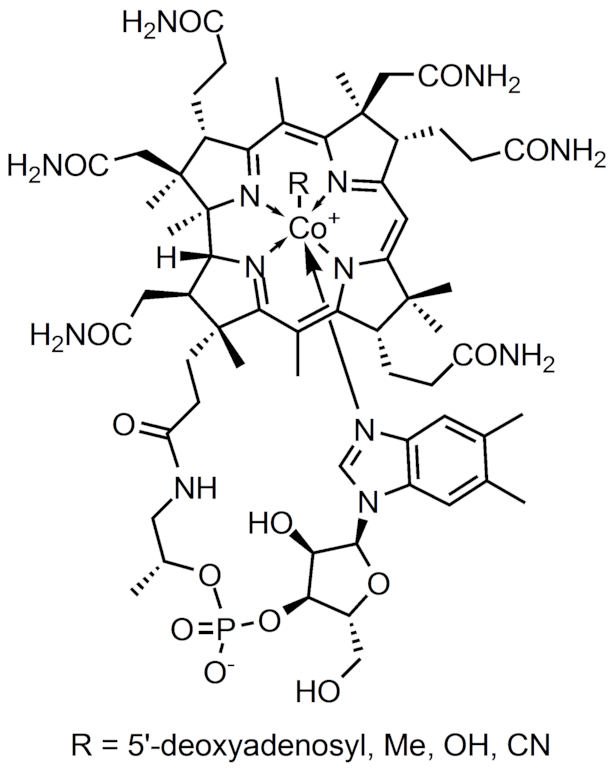
Tyto sloučeniny obsahují přímou vazbu Co-C. Setkáváme se s nimi v mnoha přírodních sloučeninách, příkladem je vitamín B12, který se označuje jako kobalamin. Základem tohoto vitamínu je kobalt koordinovaný dusíky z okolních pyrrolových jader.
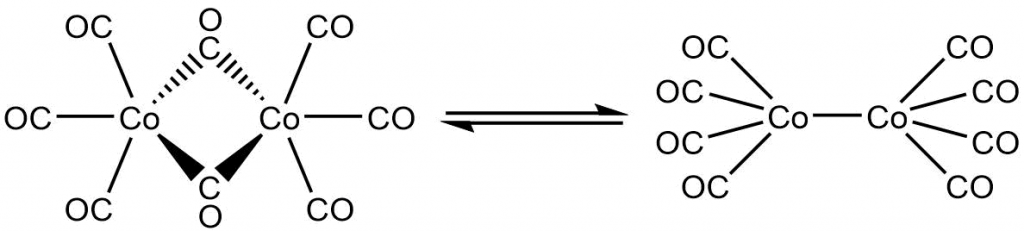
Další důležitou sloučeninou je oktakarbonyl dikobaltu, Co2(CO)8. Známe několik izomerních forem této sloučeniny, ligandy CO mohou vystupovat jako terminální, i jako můstkové. Dva hlavní izomery existující v roztoku jsou na obrázku dole.
Využívá se jako katalyzátor při mnoha organických reakcích, např. při hydroformylaci. To je syntéza aldehydu z terminálního alkenu.
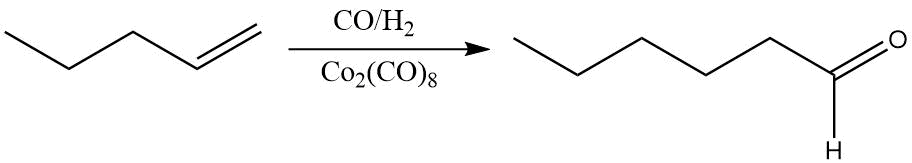
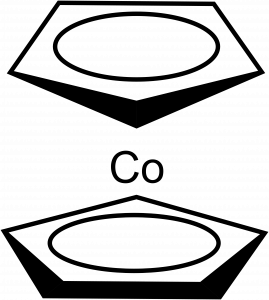
Analogen ferrocenu je kobaltocen, Co(Cp)2, tmavě fialová krystalická látka, lze ho také snadno sublimovat (podobně jako ferrocen). Můžeme ho připravit reakcí alkalického cyklopentadienidu s chloridem kobaltnatým v bezvodém tetrahydrofuranu.
Dekamethylkobaltocen je základem kobaltových dendrimerů, které patří mezi největší dosud známé molekuly. Největší dendrimer obsahuje 19683 atomů kobaltu, jeho sumární vzorec je C934893H1495830O49203Si49203Co19683P19683F118098.[7]
Využití
Nejvíce kobaltu se spotřebovává pro výrobu teplotně odolných slitin, které se využívají ve spalovacích turbínách nebo letadlových motorech. Další oblastí, kde se kobalt využívá jsou lithiové baterie, jejich katody obsahují sloučeninu LiCoO2, což je oxid kobaltitý s interkalovanými ionty lithia.
Fowlerův proces
Fluorid kobaltitý, CoF3, je velmi dobré fluorační činidlo.

Využívá se pro přípravu perfluorovaných alkanů (Fowlerův proces):[8]
C5H12 + 24 CoF3 → C5F12 + 12 HF + 24 CoF2
Vznikající fluorid kobaltnatý (CoF2) lze následně regenerovat plynným fluorem:
2 CoF2 + F2 → 2 CoF3
NMR
Kobalt je monoizotopický prvek. Jádro 59Co je kvadrupolární a má vysokou citlivost. Signály jsou široké a kobalt má i extrémně široké rozpětí chemických posunů. Standardem je roztok hexakyanokobaltitanu draselného v D2O. Kobaltnaté soli měřit nelze, protože jsou paramagnetické.
| 59Co | |
| Spin | 7/2 |
| Zastoupení v přírodě [%] | 100 |
| Citlivost vzhledem k 1H | 0,278 |
| Citlivost vzhledem k 13C | 1640 |
| Rozsah chemických posunů | -4000 – 14000 ppm |
| Rezonanční frekvence v poli 1 T | 10,077 |
| Jaderný magnetický moment | +4,627 |
Chemické posuny
| Co3+ | 14000 – 3000 |
| Co+ | 3000 – 0 |
| K3[Co(CN)6] | 0 |
| Klastry kobaltu | 0 – -4000 |
Odkazy
- Kobalt na české wikipedii
- Kobalt na anglické wikipedii
- Cobalt NMR
- 59Co : Temperature Dependent Chemical Shifts
- Selected recent developments in organo-cobalt chemistry
- HÁLA, Jiří. Radioaktivní izotopy. Tišnov: Sursum, 2013. ISBN 978-80-7323-248-1.
- Giant Cobalticinium Dendrimers
- Perfluoroalkanes
Navigace
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| H | He | ||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr |
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe |
| Cs | Ba | La | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| Fr | Ra | Ac | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |
| Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu |
| Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr |
3 Replies to “Kobalt”