Železo, Fe, nejrozšířenější přechodný kov a druhý nejrozšířenější kov na Zemi (po hliníku). Jeho slitiny (ocel, litiny, …) mají obrovské průmyslové využití.
| Atomové číslo | 26 | Počet stabilních izotopů | 4 |
| Atomová hmotnost | 55,845 | Elektronová konfigurace | [Ar] 3d6 4s2 |
| Teplota tání [°C] | 1538 | Teplota varu [°C] | 2861 |
| Elektronegativita | 1,83 | Hustota [g.cm-3] | 7,86 |
V přírodě se vyskytuje železo pouze ve vázaném stavu, nejčastěji ve formě oxidů, ze kterých se musí získávat. Výroba železa, resp. oceli probíhá nejčastěji redukcí koksem.[7] Vzhledem k tlaku na omezování produkce CO2 se hledají ekologičtější cesty výroby oceli, klasickým způsobem se uvolní zhruba dvě tuny CO2 na tunu oceli, ocelářský průmysl je odpovědný za 7 % světových emisí oxidu uhličitého. Jednou z možností je využití redukce zeleným vodíkem, tento způsob je ale zatím velmi neekonomický.[6]
Pokud potřebujeme připravit ultračisté železo, využívá se tepelný rozklad těkavého komplexu [Fe(CO)5].[4] Takto připravené železo se označuje jako karbonylové železo.
Allotropické modifikace železa
Za atmosférického tlaku známe tři allotropní modifikace železa (α, γ, δ), za vysokého tlaku se pak objevuje čtvrtá modifikace ε.
α-železo (ferit) krystaluje v tělesově centrované kubické buňce, za vysokých teplot je paramagnetické. V minulosti byla paramagnetická forma α-Fe označována jako β-Fe.
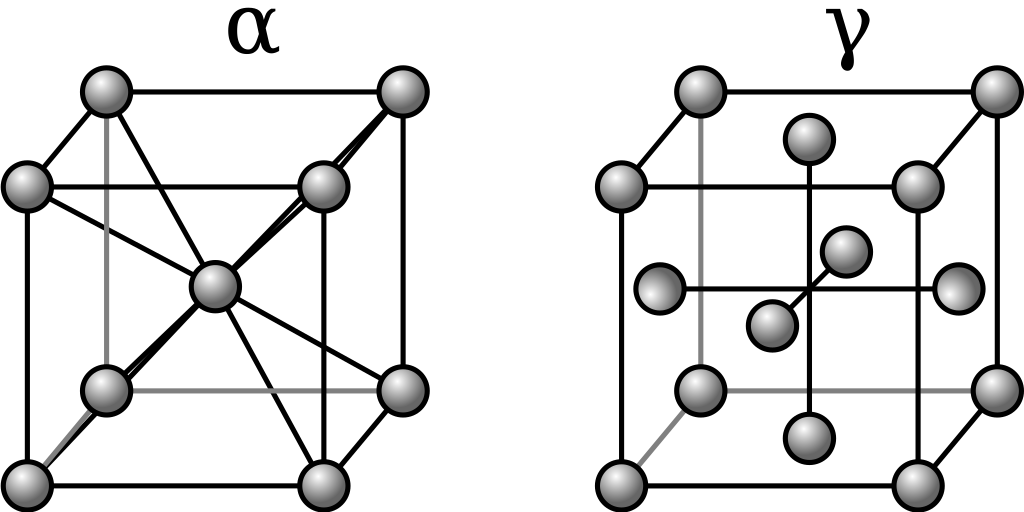
γ-železo (austenit) krystaluje v kubické, plošně centrované buňce. Fázový přechod z modifikace α na modifikaci γ probíhá při teplotě 912-1394 °C. Za laboratorní teplotě se vyskytuje v některých ocelích, kde je stabilizován niklem.
δ-železo se vylučuje z taveniny při teplotě 1538 °C, krystaluje v kubické, tělesně centrované buňce.
ε-železo vzniká při tlaku okolo 10 GPa a teplotě několik set kelvinů, zaujímá strukturu nejtěsnějšího hexagonálního uspořádání.
Sloučeniny
Železo vytváří sloučeniny v oxidačních číslech -II až VII. Nejběžnější jsou II, III a VI. V oxidačním čísle VI známe železany, anionty FeO42-. Ty mají silné oxidační vlastnosti, čehož se využívá v chemické syntéze.
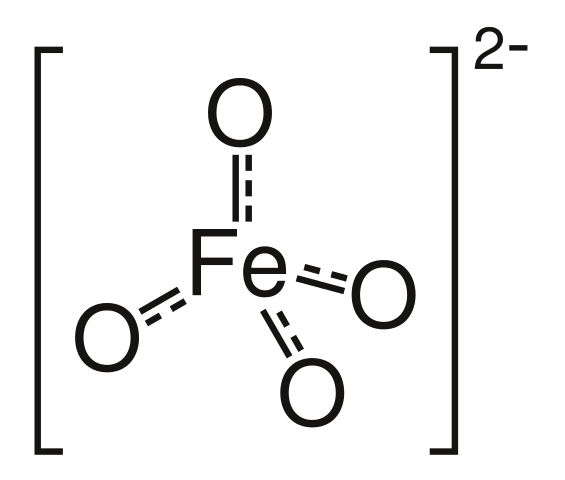

Železanový anion má tetraedrickou strukturu, podobně jako např. síran.
Síran železnatý
Síran železnatý, FeSO4, se nejčastěji vyskytuje ve formě heptahydrátu, FeSO4.7H2O. Ten má zelenou barvu, proto se označuje jako zelená skalice.
Připravuje se reakcí železa se zředěnou kyselinou sírovou a následnou krystalizací z roztoku. S koncentrovanou kyselinou by se reakce po chvíli zastavila. Vznikající síran železnatý se v kyselině sírové nerozpouští a tím dojde k zablokování povrchu železa.
Fe + H2SO4 → FeSO4 + H2
Halogenidy
| Halogenid | Barva | Tt [°C] | Tv [°C] |
| FeF3 | zelený | >1000 | |
| FeCl3 | hnědý | 308 | 316, rozklad |
| FeBr3 | hnědý | 200, rozklad | – |
| FeI3 | černý | – | – |
| FeOCl | fialový | – | – |
| FeF2 | bezbarvý | 970 | 1100 |
| FeCl2 | zelený | 677 | 1023 |
| FeBr2 | žlutohnědý | 684 | 934 |
| FeI2 | bílošedý | 587 | 827 |
Chlorid železitý, FeCl3, se vyskytuje jako bezvodý, i jako hydrát. Bezvodý je černý prášek, má strukturu BiI3, tvořenou oktaedry FeCl6 propojenými vrcholy.


Hexahydrát chloridu železitého, FeCl3.6H2O, má hnědou barvu, jeho strukturu můžeme popsat jako trans-[Fe(H2O)4Cl2]Cl.2H2O. V plynném stavu vytváří dimerní molekuly, podobně jako AlCl3.

Používá se jako vločkovací činidlo při čištění vody (stejně jako Al2(SO4)3). Dá se použít i jako leptací činidlo při domácí výrobě plošných spojů, dokáže rozpouštět měď z cuprextitových desek.
FeCl3 + Cu → FeCl2 + CuCl
FeCl3 + CuCl → FeCl2 + CuCl2
Karbonyly železa
Železo s velmi vysokou čistotou (< 97,5 %), připravuje se rozkladem pentakarbonylu železa, je to šedý prášek, skládající se z kulových částic. Nečistotami je nejčastěji uhlík, kyslík a dusík. Využívá se pro přípravu jader vysokofrekvenčních cívek a také pro materiály absorbující radarové záření, ty využívá armáda např. pro stealth technologie. Poprvé bylo připraveno roku 1925 firmou BASF.
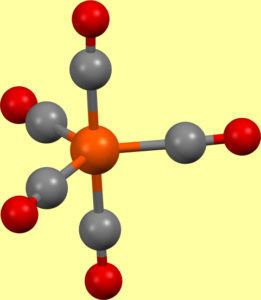
Pentakarbonyl železa se připravuje působením oxidu uhelnatého na práškové železo při tlaku 20 MPa a teplotě 150-250 °C. Je to žlutá, těkavá kapalina, je toxický. Molekula má trigonálně bipyramidální strukturu (D3h) a vykazuje tzv. Berryho pseudorotaci. Všechny úhly Fe-C-O jsou rovny 180°.[5]
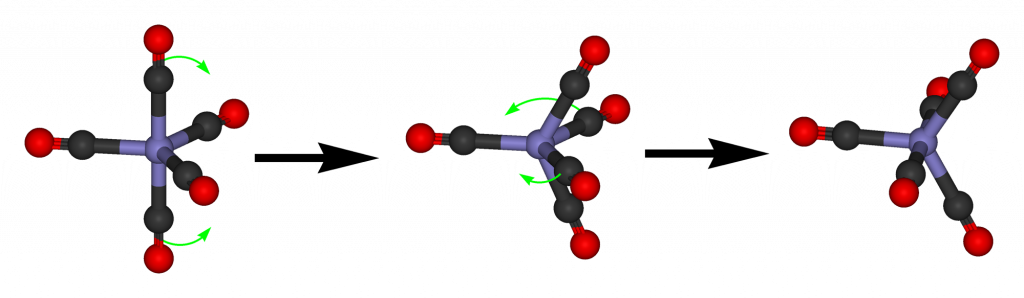
Fotodisociací pentakarbonylu železa vzniká dvoujaderný komplex Fe2CO9. V této sloučenině jsou tři karbonylové ligandy můstkové a zbylých šest terminálních. Tato sloučenina tvoří oranžové krystaly.
Zahříváním pentakarbonylu železa vzniká malé množství tmavě zelených krystalů Fe3CO12. Dva z karbonylových ligandů tvoří můstky mezi dvěma atomy železa, zbylých deset ligandů je terminálních. Klastr obsahuje dvě vazby Fe-Fe, celková symetrie je C2v.
Ferrocen
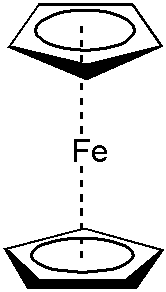
Důležitou sloučeninou železa je ferrocen, organokovová sloučenina sendvičového typu, skládá se z železnatého iontu, který je obklopen dvěma cyklopentadienylovými kruhy – Fe(C5H5)2. Poprvé byl připraven roku 1951, reakcí chloridu železnatého s cyklopentadienyl magnesiumbromidem ((C5H5)MgBr). Každý z cyklopentadienylových kruhů nese jeden záporný náboj, čímž získávají kruhy šest π elektronů a stávají se aromatickými. Všech šest elektronů z každého kruhu je zapojeno do vazby s železem, společně se šesti valenčními elektrony železnatého kationtu, získává komplex stabilní 18-elektronovou konfiguraci.[8]
Ferrocen je rozpustný ve většině běžných organických rozpouštědlech, ale nerozpustný ve vodě. Je stabilní na vzduchu, tvoří oranžové krystaly. Dobře sublimuje, už za normálního tlaku a teploty okolo 100 °C, což umožňuje jeho snadné čištění.

V roce 2016 se povedlo připravit první cyklické oligomery ferrocenu, kde byly jednotky vázané kovalentní vazbou uhlík-uhlík mezi cyklopentadienylovými kruhy.
V roce 2022 byla publikována příprava anorganického analogu ferrocenu s kruhy tvořenými fosforem.
NMR
Železo má jeden NMR aktivní izotop s nízkým zastoupením. Díky spinu 1/2 poskytuje úzké signály, škála chemických posunů je velmi široká (cca 2500 ppm). Železité soli jsou paramagnetické, proto je nelze měřit. Pro NMR jsou zajímavé soli železa v oxidačním stupni 0 a +2. Standardem je pentakarbonyl železa.
| 57Fe | |
| Spin | 1/2 |
| Zastoupení v přírodě [%] | 2,119 |
| Citlivost vzhledem k 1H | 7,24×10-7 |
| Citlivost vzhledem k 13C | 4,25×10-3 |
| Rozsah chemických posunů | -100 – 2500 ppm |
| Rezonanční frekvence v poli 1 T | 1,3816 |
| Jaderný magnetický moment | +0.0906230 |
Chemické posuny
| Feroceny | 2500-1500 |
| FeCp2 | 1550 |
| Karbonyly | 1400 – -100 |
| Fe(CO)5 | 0 |
Odkazy
- Železo na české wikipedii
- Železo na anglické wikipedii
- Iron NMR
- Preparation of iron powder by the thermal decomposition of iron pentacarbonyl
- The crystal structure of iron pentacarbonyl
- Vznikla první ocel bez využití fosilních paliv
- Když železo ještě teklo
- Forever young: the first seventy years of ferrocene
Navigace
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| H | He | ||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr |
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe |
| Cs | Ba | La | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| Fr | Ra | Ac | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |
| Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu |
| Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr |

13 Replies to “Železo”