Amoniak (NH3) je jednou z nejdůležitějších syntetických surovin, připravuje se převážně Haberovým-Boschovým procesem, kdy jsou dusík a vodík vystaveny tlaku 100 atmosfér (přibližně 10 MPa) a teplotě 500 °C. Tato syntéza je energeticky extrémně náročná, spotřebuje zhruba 1 % z celosvětové produkce energie a je odpovědná za 1,4 % emisí oxidu uhličitého.[5] Nyní byla publikována metoda, která slibuje výrobu amoniaku mechanochemicky za atmosférického tlaku a při teplotě 45 °C.[1,2]

Haberova-Boschova syntéza amoniaku
Jde o jedinou používanou metodu pro průmyslovou výrobu amoniaku. Vyvinuta byla na počátku 20. století chemiky Fritzem Haberem a Carlem Boschem. Jako výchozích látek využívá plynný dusík a vodík.[3-6]
Molekulární dusík je poměrně inertní plyn (proto se využívá jako ochranná atmosféra při manipulaci s látkami citlivými na vlhkost a kyslík) a je velmi obtížné ho donutit k reakci.
N2 (g) + 3 H2 (g) → 2 NH3 (g)
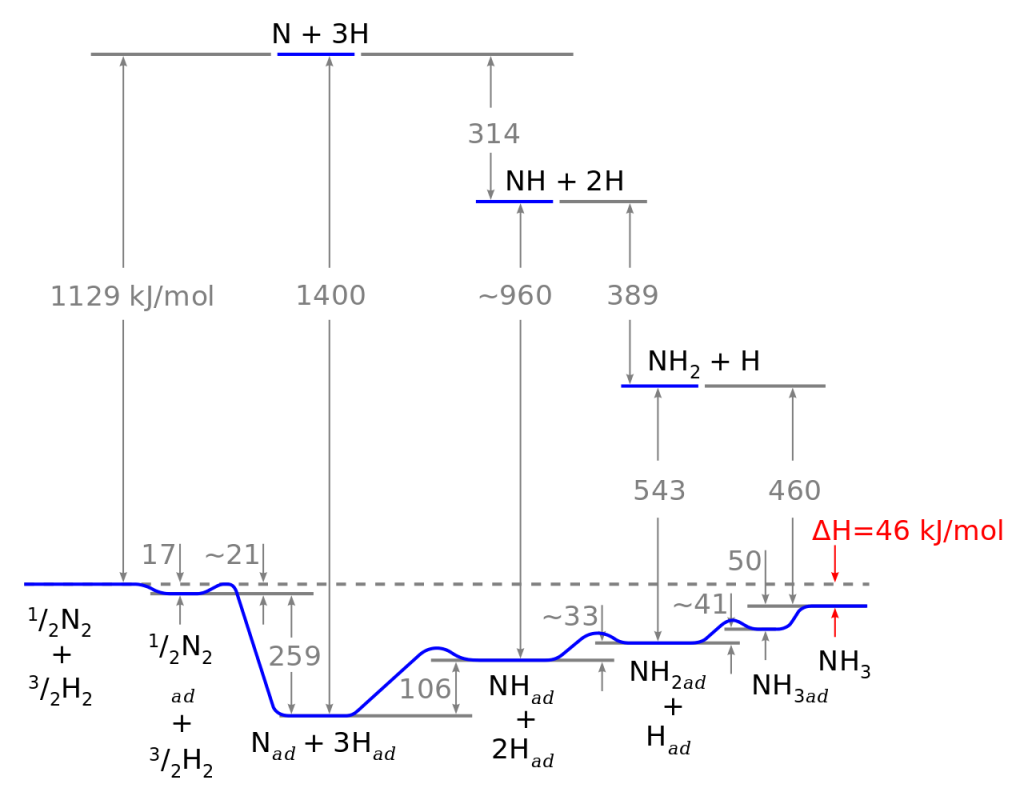
Aby byla reakce proveditelná, je nutné využít kovový katalyzátor. Ten způsobí disociaci dusíku i vodíku na monoatomické částice, které jsou podstatně reaktivnější.
Jako katalyzátor se v současnosti používají oxidy železa, společně s oxidem vápenatým a hlinitým. Dříve se využívalo i osmium, ale od toho se upustilo (kvůli špatné dostupnosti a vysoké ceně).
Obrázek dole ukazuje schéma celého procesu. Jako zdroj vodíku slouží methan, který se reakcí s vodní parou na niklovém katalyzátoru převádí na vodík a oxid uhličitý.
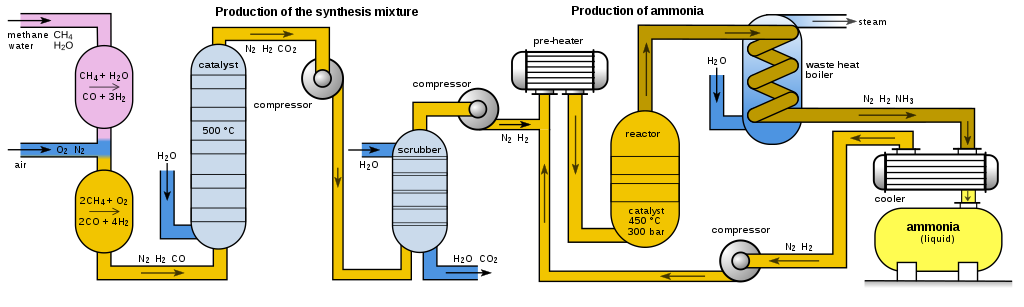
Reakce je exotermní, proto by se měla reakční směs spíše chladit, ale pro správnou funkci katalyzátoru je nutná teplota okolo 500 °C. Jelikož během reakce dochází k poklesu tlaku (ze čtyř molů plynu vznikají dva), provádí se za zvýšeného tlaku.
Video s laboratorním provedením syntézy amoniaku najdete na odkazu [6].
Mechanochemie
Mechanochemie je chemická syntéza, kde je energie do reakční směsi dodávána pomocí mechanické energie. Nejčastěji jde o mletí pevných reaktantů v kulovém mlýnu.[6]


Mechanochemická syntéza amoniaku
Nová metoda výroby amoniaku je založena na mechanochemické reakci plynného dusíku s vodíkem. Suroviny tedy zůstávají stejné, ale prudce klesá náročnost výroby, protože probíhá za atmosférického tlaku a teploty pouhých 45 °C.
Syntéza je zachycena na videu, které je dostupné v supplementu [2]. Do reaktoru je nejprve vloženo 500 g ocelových koulí a 24 g železného prášku, který slouží jako katalyzátor. Poté je reaktor napuštěn dusíkem a mletím dochází k reakci s povrchem železa za vzniku meziproduktu popisovaného jako: [Fe(N*)]. Dusík se sorbuje na povrch zrn železa a disociuje tam na atomární formu, která je pochopitelně podstatně reaktivnější než molekula dusíku. Poté je reaktor napuštěn vodíkem a dochází k dalšímu mletí, tím už vzniká konečný produkt – amoniak.
Jde o velice zajímavou možnost využití mechanochemie, výzkumný tým nyní hledá efektivnější katalyzátor a snaží se o nový design reaktoru, který by umožnil kontinuální výrobu amoniaku. Vzhledem k tomu, že Haberova-Boschova metoda je už více než 100 let stará, tak by si určitě zasloužila nahrazení energeticky úspornější technologií.
Samozřejmě se hledají i další cesty, např. fotoelektrochemická výroba amoniaku.
Odkazy
- Violent mechanochemical impacts replace extreme conditions for ammonia synthesis
- Mechanochemistry for ammonia synthesis under mild conditions
- HABER & BOSCH
- Uses and Production of Ammonia by the Haber Process
- Electrifying the Haber–Bosch
- Haber Process
- Hallmarks of mechanochemistry: from nanoparticles to technology
One Reply to “Mechanochemická syntéza amoniaku”