Platina, Pt, patří mezi drahé kovy, má velice vysokou hustotu a je chemicky velmi odolný. Mechanicky jde o měkký kov. Využívá se jako materiál pro vysokoteplotní aplikace (termočlánky, kelímky pro TG/DSC), v katalyzátorech (např. pro automobily).
| Atomové číslo | 78 | Počet stabilních izotopů | 5 (6) |
| Atomová hmotnost | 195,084 | Elektronová konfigurace | [Xe] 4f14 5d9 6s1 |
| Teplota tání [°C] | 1768,3 | Teplota varu [°C] | 3825 |
| Elektronegativita | 2,28 | Hustota [g.cm-3] | 21,45 |
Izotopy
Přírodní platina se skládá z šesti izotopů, z nichž pět je stabilních, 198Pt má velmi vysoký poločas rozpadu (více než 3×1014 roku). Obsahuje také 0,012 % radioaktivního izotopu 190Pt (6,5.1011 roků). Známe izotopy platiny v rozmezí 166Pt – 202Pt.
| Izotop | Zastoupení v přírodě | Poločas rozpadu |
|---|---|---|
| 190Pt | 0,012 % | 4,83×1011 let |
| 192Pt | 0,782 % | stabilní |
| 194Pt | 32,967 % | stabilní |
| 195Pt | 33,832 % | stabilní |
| 196Pt | 25,242 % | stabilní |
| 198Pt | 7,163 % | stabilní |
Výskyt v přírodě
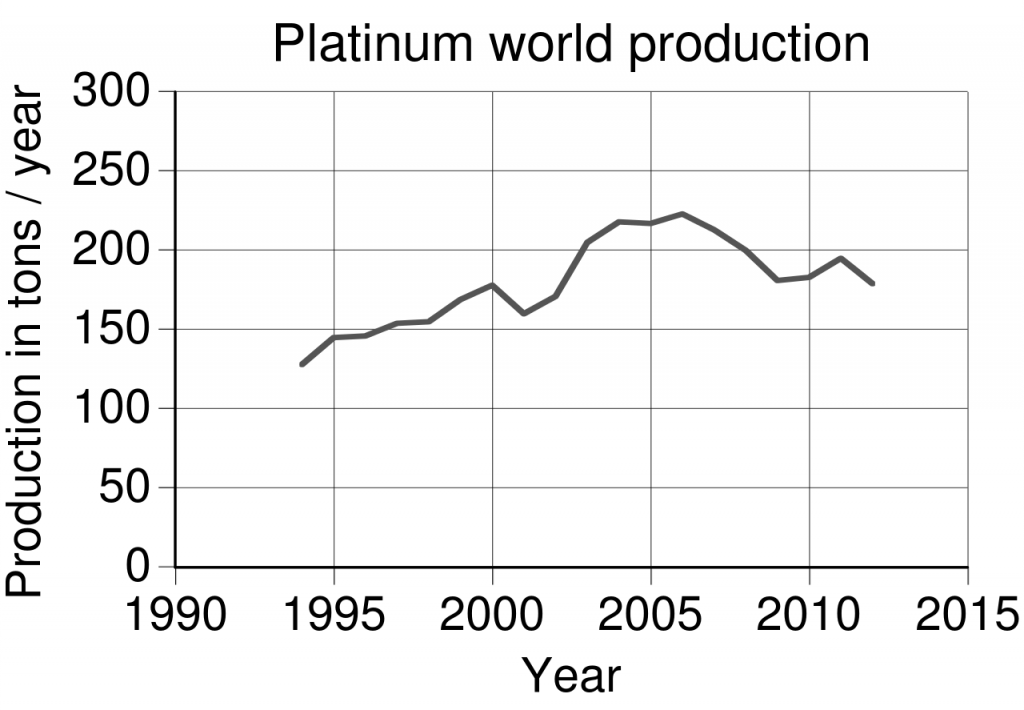
Platina je velice vzácný prvek, průměrná koncentrace v zemské kůře je jen 0,005 ppm. Jeho hlavní producenty znázorňuje mapka na obr. 1. Roční objem výroby platiny se pohybuje kolem 150-200 tun.
Čištění a tavba platiny
Následující dvě videa ukazují postup čištění a tavby platiny získané z platinových kelímků.
Chemické vlastnosti
Chemicky jde o velice odolný prvek, dobře se rozpouští v lučavce královské (rovnice 1), pomalu v kyselině dusičné a chlorovodíkové (za přítomnosti kyslíku nebo peroxidu vodíku). Vytváří sloučeniny v oxidačních číslech +2 a +4, méně běžně +1 a +3.
Pt + 4 HNO3 + 6 HCl → H2PtCl6 + 4 NO2 +4 H2O (1)
Oba oxidy platiny, PtO a PtO2, se teplem rozkládají. Směsný oxid vzniká iontovou reakcí:
2 Pt2+ + Pt4+ + 4 O2- → Pt3O4
PtO2 je základem Adamsova katalyzátorů, který se využívá pro hydrogenaci a hydrogenolýzu organických sloučenin.[3] Ten se vyrábí reakcí kyseliny hexafluoroplatiničité s dusičnanem sodným a následným tepelným rozkladem vzniklého dusičnanu.
H2PtCl6 + 6 NaNO3 → Pt(NO3)4 + 6 NaCl + 2 HNO3
Pt(NO3)4 → PtO2 + 4 NO2 + O2
Halogenidy
| Oxidační stav | Fluoridy | Chloridy | Bromidy | Jodidy |
| II | PtF2 černý | PtCl2 olivově zelený Tt=581 °C Tv=rozklad | PtBr2 hnědý Tt=250 °C (rozklad) | PtI2 černý Tt=360 °C |
| III | PtCl3 černozelený Tt=400 °C (rozklad) | PtBr3 černozelený Tt=200 °C (rozklad) | PtI3 černý Tt=310 °C (rozklad) | |
| IV | PtF4 žlutohnědý Tt=600 °C | PtCl4 červenohnědý Tt=370 °C | PtBr4 hnědočerný Tt=130 °C (rozklad) | PtI4 hnědočerný Tt=130 °C (rozklad) |
| V | [PtF5]4 tmavě červený Tt=75-76 °C Tv=300-305 °C | |||
| VI | PtF6 tmavě červený Tt=61,3 °C Tv=69,14 °C |
Fluorid platinový, PtF6, je tmavě červená pevná látka, která vzniká přímou reakcí platiny s fluorem nebo disproporcionací fluoridu platinového:
2 PtF5 → PtF6 + PtF4
Molekula má tvar oktaedru. Je to velmi silné oxidační činidlo, kyslík dokáže oxidovat na dioxygenylový kation, O2PtF6. Podobně reaguje i s xenonem, dochází ke vzniku XePtF6.
Fluorid platiničný, PtF5, je červená pevná látka. Vytváří tetramerní cyklické molekuly (PtF5)4, lze ho připravit oxidací chloridu platnatého plynným fluorem:
2 PtCl2 + 5 F2 → 2 PtF5 + 2 Cl2
Snadno podléhá disproporcionačním reakcím.
Komplexní sloučeniny
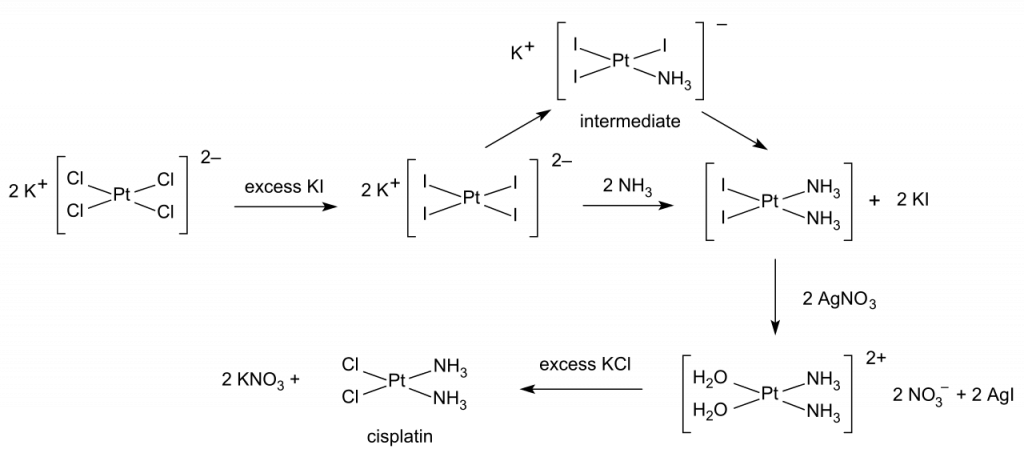
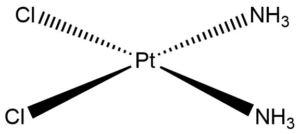
Chemie komplexních sloučenin platiny je poměrně rozsáhlá. Mezi nejznámější komplexy patří tzv. cis-platina, která se využívá při léčbě rakoviny. Jde o komplex cis-[Pt(NH3)2Cl2].[5]
Cisplatina se používá pro léčbu nádorů krku, močového měchýře, varlat a vaječníků. Cisplatinu lze připravit z tetrachloroplatnatanu draselného, K2[PtCl4].
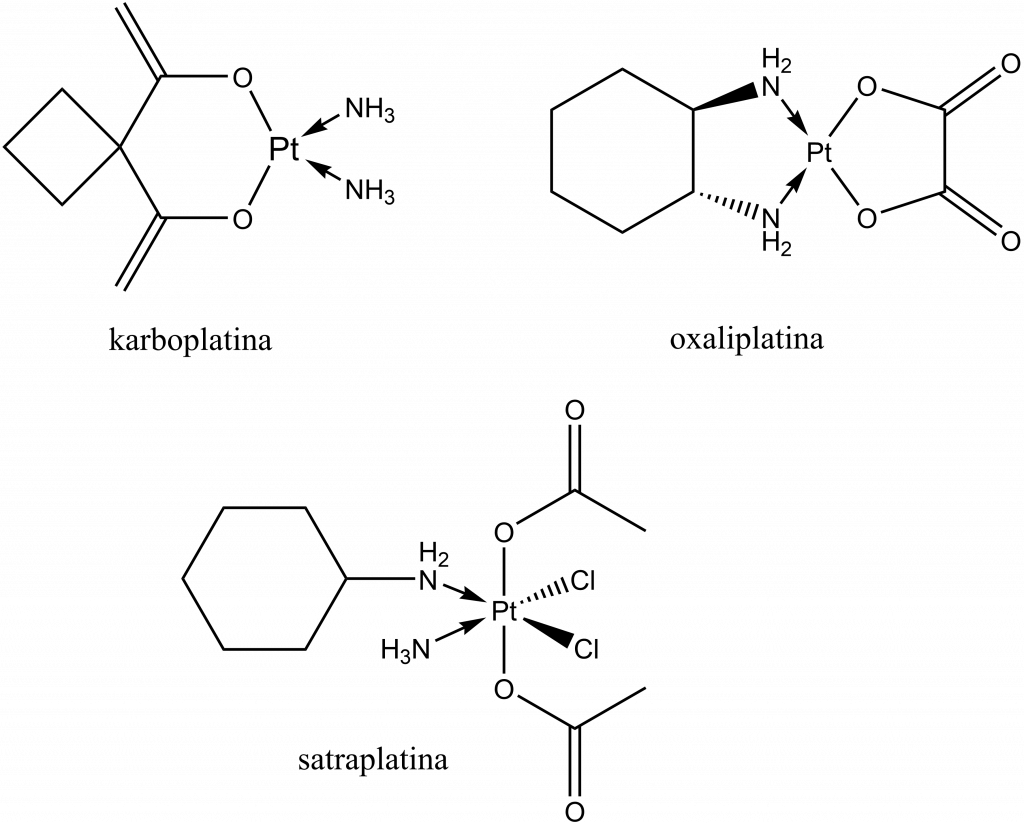
Dalšími schválenými léčivy obsahujícími platinu jsou karboplatina a oxaliplatina. Satraplatina je ve fázi schvalování.
Pomocí komplexů platiny byl také studován tzv. trans-efekt, který umožňuje předpovídat strukturu produktu substitučních reakcí u komplexů.
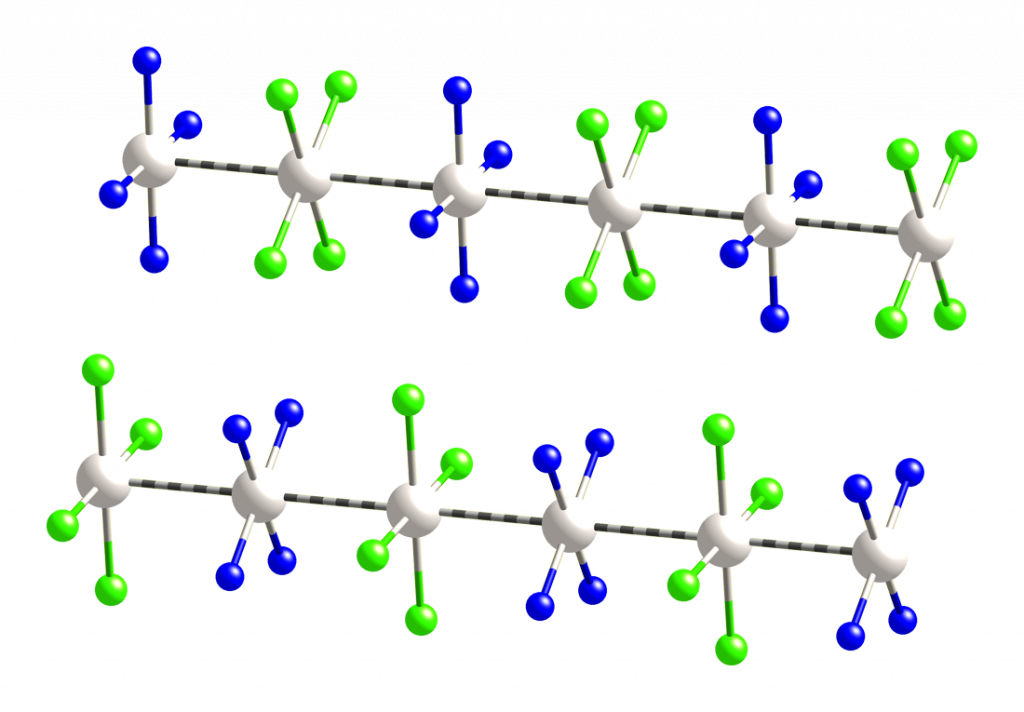
Magnusova zelená sůl, [Pt(NH3)4][PtCl4], je komplexní sloučenina pojmenovaná po jejím objeviteli Heinrichu Gustavovi Magnusovi. Jde o tmavě zelenou krystalickou látku, kterou lze připravit srážením chloridu tetraamminplatnatého pomocí roztoku tetrachloroplatnatanu. Krystalová struktura obsahuje řetězce, ve kterých se střídají kationty a anionty poutané interakcí Pt-Pt.
Oxidační číslo 10
Výpočty bylo zjištěno, že by platina mohla dosáhnout i oxidačního stavu +10, např. u iontu PtO42+.[4]
NMR
Platina má jeden, středně citlivý, NMR aktivní izotop 195Pt. Využívá se hlavně pro studium komplexů platiny, důležitou informaci lze zjistit i ze štěpení jádry 1H, 13C, 31P, atd. Jako standard se používá roztok Na2PtCl6 (hexachloroplatičitanu sodného) v D2O.
| 195Pt | |
| Spin | 1/2 |
| Zastoupení v přírodě [%] | 33,832 |
| Rozsah chemických posunů | -6500 až 200 ppm |
| Rezonanční frekvence v poli 1 T | 9,2922 |
| Jaderný magnetický moment | +0,60952 |
| Citlivost vůči 1H | 3,51×10-3 |
| Citlivost vůči 13C | 20,7 |
Odkazy
- Platina české wikipedii
- Platina na anglické wikipedii
- The Story of Adams‘ Catalyst
- Oxidation state +10 may exist in a platinum compound
- Metals in Cancer Research: Beyond Platinum Metallodrugs
Navigace
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| H | He | ||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr |
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe |
| Cs | Ba | La | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| Fr | Ra | Ac | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |
| Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu |
| Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr |

![Struktura aniontu [PtCl6]-](http://z-moravec.net/wp-content/uploads/2015/03/PtCl6-290x300.png)
3 Replies to “Platina”