Jodometrie je metoda redoxní odměrné analýzy. Využívá se jak redukčních, tak i oxidačních vlastností jódu. Lze tedy stanovovat jak redukující, tak i oxidující látky.
I2 + 2 e– ⇌ 2 I–
Odměrné roztoky
Využívají se dva typy odměrných roztoků, roztok jódu a roztok thiosíranu sodného (Na2S2O3).
Elementární jód se ve vodě nerozpouští, proto se využívá reakce s jodidem draselným za vzniku rozpustného trijodidu draselného:
I2 + KI 🠒 KI3
V případě, že máme k dispozici resublimovaný jód, jedná se o základní látku a můžeme jej přesně navážit. Jen je potřeba myslet na těkavost jódu a využívat uzavíratelné váženky. Zpravidla se ale faktorizuje titrací thiosíranem nebo pomocí oxidu arsenitého.

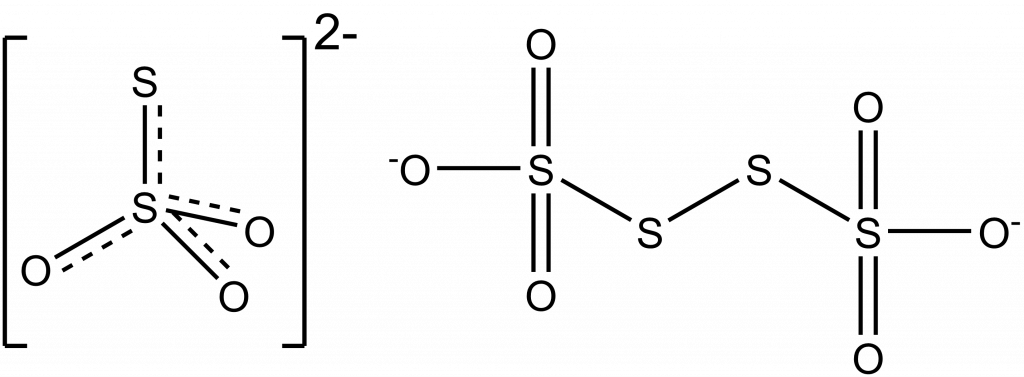
Thiosíran sodný se využívá k nepřímému jodometrickému stanovení, kdy se nejprve reakcí nadbytku jodidu s oxidačním činidlem vyloučí jód a ten se poté titruje thiosíranem sodným za vzniku tetrathionanu.
I2 + 2 Na2S2O3 🠒 Na2S4O6 + 2 NaI
Indikátor
Jako indikátor se využívá roztok škrobu, který s trijodidem vytváří supramolekulární komplex s intenzivní modrou barvou.
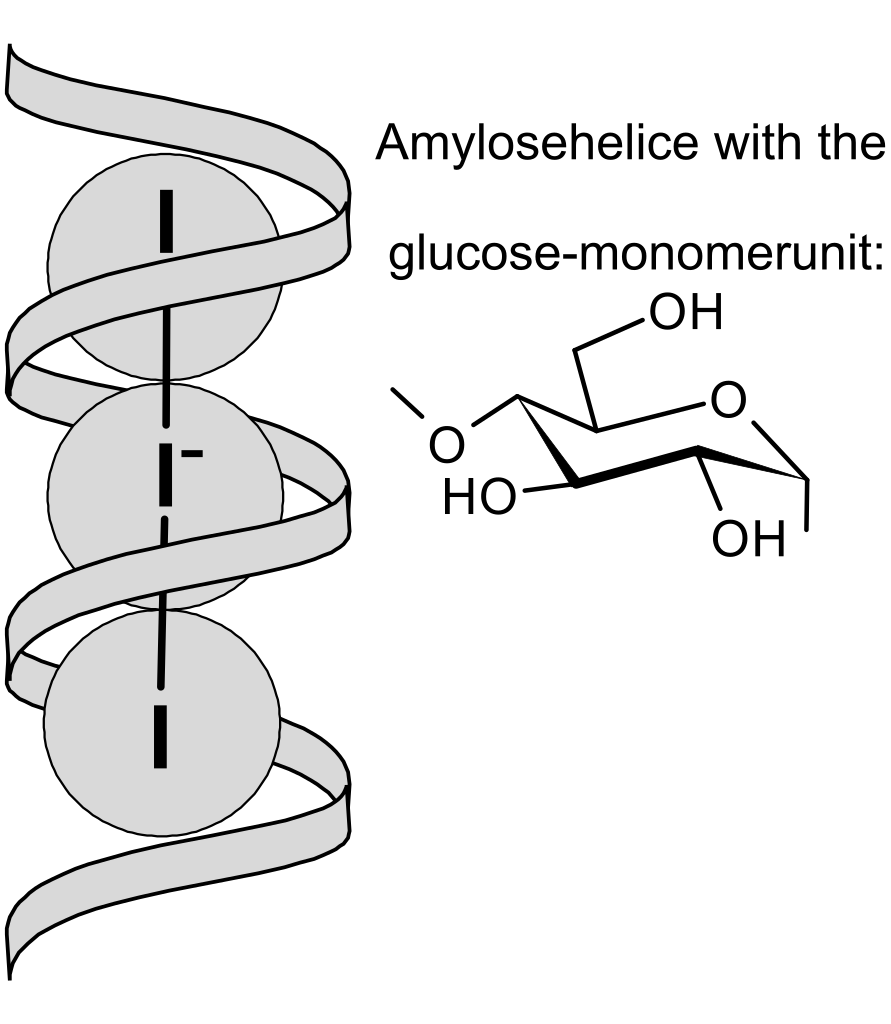
Tato reakce je velmi citlivá a umožňuje detekci i velmi nízkých koncentrací trijodidu.

Využití
Stanovení redukujících látek
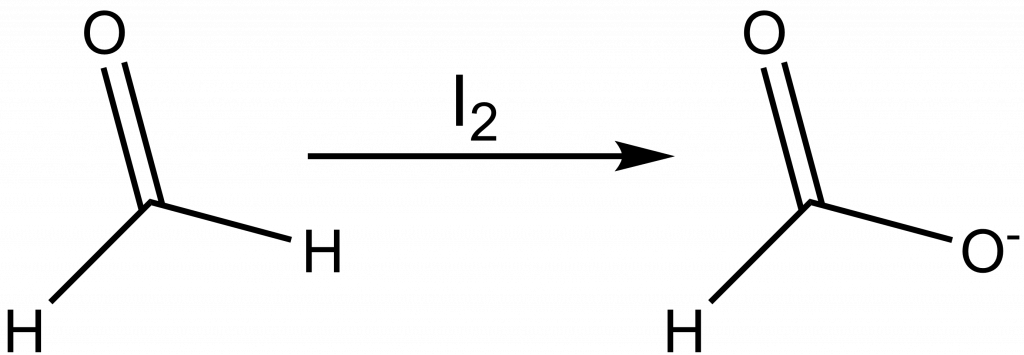
Pokud reakce probíhá dostatečně rychle, je možné titrovat přímo roztokem jódu. Pokud je rychlost nízká, přidává se k analytu přesně známý nadbytek jódu a nezreagovaný jód se titruje odměrným roztokem thiosíranu. Můžeme tak stanovit arsenité a antimonité soli, siřičitany a aldehydy.
SO32- + I2 + H2O 🠒 SO42- + 2 I– + 2 H+
HCOH + I2 + 3 OH– 🠒 HCOO– + 2 H2O + 2 I–
Stanovení oxidujících látek
Oxidující látky se nejprve nechají reagovat s nadbytkem jodidu a poté se titruje získaný jód roztokem thiosíranu sodného. Množství jodidu není nutné znát přesně, ale musí být dostatečné s ohledem na množství analytu. Takto můžeme stanovit koncentraci dichromanu, manganistanu, chloru, bromu a dalších oxidačních činidel.
2 MnO4– + 10 I– + 16 H+ 🠒 5 I2 + 2 Mn2+ + 8 H2O
Br2 + 2 I– 🠒 I2 + 2 Br–
Další kapitoly
- České chemické názvosloví
- Platné číslice a měření
- Základní chemické zákony
- Důležité veličiny a vztahy v chemii
- Výpočet stechiometrického vzorce
- Chemické rovnice a stechiometrické výpočty
- Koncentrace roztoků
- Rozpustnost, součin rozpustnosti
- Stavba atomu
- Periodická tabulka prvků a periodicita vlastností
- Chemická vazba
- VSEPR
- Komplexní sloučeniny
- Magnetické vlastnosti látek
- Termodynamika
- Chemická rovnováha
- Skupenské stavy látek
- Fázové rovnováhy
- Teorie kyselin a zásad
- pH, aktivita roztoku
- Elektrochemie
- Symetrie molekul
- Laboratorní technika
- Lineární regrese
- Jednotky tlaku
- Jednotky teploty
- Mohsova stupnice tvrdosti minerálů
- Odkazy
- Prezentace k semináři z obecné chemie