Lanthanoidy jsou skupinou 15. prvků s protonovým číslem od 57 do 71, od lanthanu až po lutecium. Souhrně se označují zkratkou Ln.
| Název | Značka | Protonové číslo |
|---|---|---|
| Lanthan | La | 57 |
| Cer | Ce | 58 |
| Praseodym | Pr | 59 |
| Neodym | Nd | 60 |
| Promethium | Pm | 61 |
| Samarium | Sm | 62 |
| Europium | Eu | 63 |
| Gadolinium | Gd | 64 |
| Terbium | Tb | 65 |
| Dysprosium | Dy | 66 |
| Holmium | Ho | 67 |
| Erbium | Er | 68 |
| Thulium | Tm | 69 |
| Ytterbium | Yb | 70 |
| Lutecium | Lu | 71 |

Lanthanoidy nepatří mezi vzácné prvky, kromě nestabilního promethia, je zastoupení všech lanthanoidů v zemské kůře v jednotkách až desítkách ppm. Získávají se především ze dvou rud – monazitu a bastnezitu. Mají stříbřitý vzhled a jsou poměrně měkké. Některé lanthanoidy nacházíme i v biologických systémech.[1]


Elektronová konfigurace lanthanoidů většinou odpovídá zápisu [Xe]4fn5d06s2.
Chemické vlastnosti
Chemické i fyzikální vlastnosti lanthanoidů si jsou poměrně dost podobné, to je z velké části dáno tzv. lanthanoidovou kontrakcí. Tvoří sloučeniny převážně v oxidačním stavu +III, výjimkou je cer, který vytváří i ceričité sloučeniny.
Známe také poměrně bohatou množinu organokovových sloučenin lanthanoidů.[2]
Lanthanoidová kontrakce
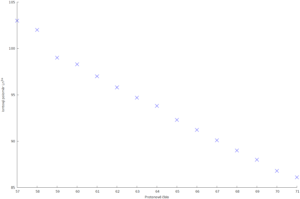
Pojmem lanthanoidová kontrakce označujeme klesající iontový poloměr lanthanoidů se stoupajícím protonovým číslem. Tento jev se dá vysvětlit slabým stíněním náboje jádra elektrony z orbitalů 4f. To způsobí přiblížení elektronů 6s blíže k jádru a tím i zmenšení iontového poloměru. Závislost poloměru na protonovém čísle je zobrazena dole:
Druhou příčinou kontrakce je tzv. relativistický efekt, kdy se elektrony na vnitřních drahách pohybují tak vysokou rychlostí, že dochází ke zvýšení jejich hmotnosti. Z toho důvodu se musí více přiblížit k jádru.
Výskyt
Lantahnoidy patří mezi poměrně běžné prvky, výjimkou je promethium, které nemá žádný stabilní izotop. Nejvyšší zastoupení v zemské kůře má cer, nejnižší pak lutecium.
Nejběžnější minerály lanthanoidů jsou:
- Monazity, (Ce, La, Th, Nd, Y)PO4
- Bastnäzity, (Ce, La, Y)CO3F
- Samarskit (Y,Ce,U,Fe)3(Nb,Ta,Ti)5O16
Odkazy
- The Chemistry of Lanthanides in Biology: Recent Discoveries, Emerging Principles, and Technological Applications
- Back to the future of organolanthanide chemistry
Navigace
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| H | He | ||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr |
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe |
| Cs | Ba | La | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| Fr | Ra | Ac | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |
| Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu |
| Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr |