Chemie uhlíku, organická i anorganická, je velice bohatá, v tomto článku bych se chtěl zaměřit na alotropické modifikace uhlíku, kterých je v současnosti známo velké množství. Mezi nejznámější patři samozřejmě diamant, grafit a fulleren, ale tím výčet ani zdaleka nekončí.

Za standardní teploty a tlaku je stabilní formou uhlíku grafit, diamant je stabilní až za vysokého tlaku.
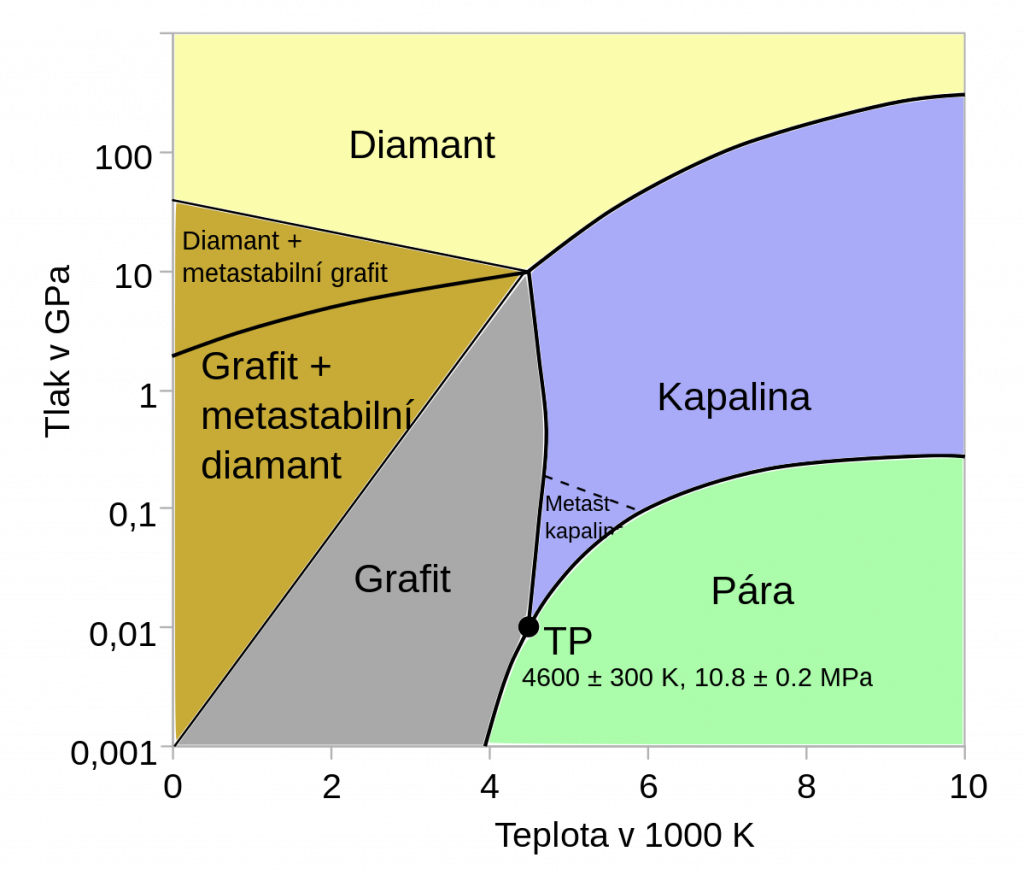
Diamant
Krystalická forma uhlíku, nejtvrdší přírodní minerál. Chemicky je velmi inertní, nereaguje ani se silnými kyselinami a zásadami. Působí na něj pouze některá silná oxidační činidla za vysokých teplot. Má vyšší hustotu než grafit, což umožňuje jeho výrobu z grafitu působením vysokého tlaku. Výroba umělých diamantů probíhá rozpuštěním grafitu v tavenině železa a následnou krystalizací za vysokého tlaku. Následně se železo rozpustí v kyselině. Syntetické diamanty mají velikost od 0,05 do 0,5 mm a využívají se jako brusný materiál, v řezných plátcích nebo jako leštící prášky.
Diamanty se těží v Indii, Brazílii, Jižní Africe a Rusku a nacházejí významné využití v průmyslu jako brusný materiál a samozřejmě v optice. Pro brusiva se využívají nekvalitní přírodní nebo syntetické diamanty, pro optické aplikace je naopak důležité použít co nejkvalitnější. Ve starých vrstvách zemského pláště, v hloubce okolo 200 km, je pravděpodobně obrovská zásobárna diamantů, ale zatím mimo dosah naší techniky.[2]
Diamant lze využít i v polovodičovém průmyslu, např. pro výrobu PN přechodu UV LED diod.
V roce 2020 byla teoreticky předpovězena existence tzv. pentadiamantu, který má vyšší tvrdost než přírodní diamant.
Odkazy
- Diamond – the extreme King of Gems
- Sound waves reveal diamond cache deep in Earth’s interior
- Nanodiamanty pro zobrazení lymfatických uzlin
Grafit
Šesterečný uhlíkový minerál, oproti diamantu podstatně měkčí minerál (tvrdost 1-2). Využívá se jako černý pigment, tuha do obyčejných tužek, materiál pro vysokoteplotní aplikace, dále ho najdeme např. v elektromotorech a jaderných reaktorech. Je to velmi měkký nerost, proto se využívá jako mazivo.
Je tvořen planárními šestiuhlíkatými cykly, které vytvářejí roviny. V šesterečném grafitu jsou vrstvy uspořádány do sekvence ABAB, v β-grafitu je pořadí vrstev ABCABC. U obou forem je vzdálenost vrstev 335,4 pm a vzdálenost uhlíků v rámci jedné vrstvy je 141,5 pm. Obě formy grafitu lze mezi sebou převádět mletím (α→β) nebo ohřevem na 1025 °C (β→α).
Grafit je mnohem reaktivnější než diamant, v kyslíku za vyšší teploty (nad 700 °C) hoří na oxid uhličitý, horká kyselina dusičná oxiduje grafit na karboxylové kyseliny. S fluorem reaguje na polymerní monofluorid CFn (n<=1), za vyšší teploty vzniká tetrafluormethan.
Důležitou skupinou sloučenin grafitu jsou jeho interkaláty, kdy mezi uhlíkové vrstvy vpravíme atomy, ionty nebo molekuly. Během interkalace dochází ke zvyšování vzdálenosti uhlíkových vrstev. Interkalace atomů nebo iontů je spojena buď s redukcí nebo oxidací grafitu:
- Redukci grafitu způsobují kovy 1. a 2. skupiny a některé lanthanoidy.
- Oxidaci pak způsobují oxidační činidla typu HNO3, Br2 nebo i H2SO4.
Odkazy
Chaoit, bílý uhlík
Poprvé byl nalezen v Bavorsku v roce 1968, lze ho připravit i uměle sublimací grafitu při teplotě 2700-3000 K nebo laserovým ozařováním grafitu ve vysokém vakuu. Jde o hexagonální nerost, tvrdost 1-2. Jak je vidět z názvu, jeho barva je bílá až šedá, hustota okolo 3,43 g.cm-3. Jeho stopy byly nalezeny také v meteoritech.
Lonsdaleit
Někdy se označuje jako hexagonální diamant. Vzniká při dopadu meteoritů obsahujících uhlík na Zemi. Při dopadu dojde ke zvýšení teploty a tlaku na extrémní hodnoty, které způsobí jeho přeměnu na diamant, ale přeměna je tak rychlá, že hexagonální krystalová mřížka grafitu zůstane zachována.
Podařilo se jej připravit i uměle v laboratoři a to buď použitím vysokého statického tlaku nebo tlakovým pulzem pomocí výbušniny.
Odkazy
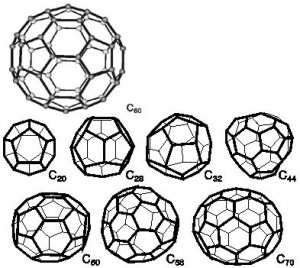
Fullereny
Fullereny jsou molekuly tvořené pěti- a šestičlennými uhlíkovými cykly, které jsou uspořádány do kulového nebo elipsoidního tvaru, příp. mohou tvořit i trubice – uhlíkové nanotrubice. Do vzniklé dutiny je možné uzavřít atomy nebo malé molekuly, čímž získáme endohedrální deriváty fullerenů. Některé z těchto sloučeniny vykazují zajímavé vlastnosti.
První příprava fullerenů byla popsána v roce 1985 odpařováním grafitu laserem. Od té doby bylo vyvinuto několik dalších metod jejich přípravy, např. elektrickým obloukem mezi grafitovými elektrodami v heliové atmosféře.
Reaktivita fullerenů je poměrně široké a intenzivně zkoumané téma, pár článků je i na tomto webu.
Reakce s halogeny probíhá adičním mechanismem. S fluorem mohou vznikat deriváty, kde jsou atomy fluoru navázány na sousední uhlíky, ostatní halogeny jsou moc velké a vážou se na vzdálenější atomy. Adice způsobuje deformace tvaru fullerenové klece, protože dochází ke změně hybridizace uhlíků z sp2 na sp3.
Oxidace kyslíkem probíhá také jako adice na dvojnou vazbu. Pokud použijeme ozon vznikne ozonid, který snadno uvolňuje molekulu kyslíku. Struktura produktu pak závisí na podmínkách. Fotolyticky dochází k rozštěpení fullerenové klece a vzniku kyslíkového můstku mezi atomy uhlíku. Fullereny s hydroxoskupinami se nazývají fullerenoly.
Odkazy
- Kroto, H.W.; Heath, J. R.; Obrien, S. C.; Curl, R. F.; Smalley, R. E. (1985). „C60: Buckminsterfullerene“. Nature 318 (6042): 162–163. Doi:10.1038/318162a0
- Sladký fulleren
- Příprava He@C60 a He2@C60 pomocí exploze
- Komplex [Ni(dppp)(η2-C60)]
-
Uhlíkové nanotrubice
Jsou to alotropy uhlíku s válcovou strukturou, tyto molekuly mají zajímavé vlastnosti jichž se využívá např. v nanotechnologiích, elektronice a optice. Řadí se mezi fulereny. Rozdělují se na jednostěnné nanotrubice (SWCNT – Single Walled Carbon NanoTubes) a vícestěnné nanotrubice (MWCNT – Multi Walled Carbon NanoTubes).
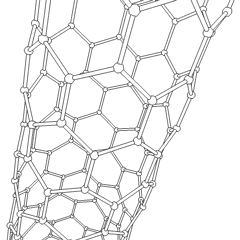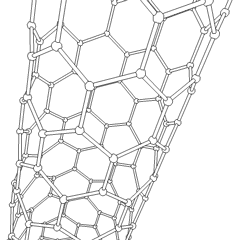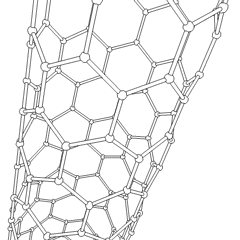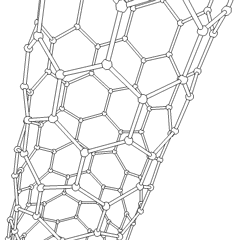
Uhlíková nanotrubice
Zdroj: Saperaud/CommonsVýroba uhlíkových nanotrubic je možná několika způsoby, pro větší množství se využívá obloukový výboj, laserová ablace, rozklad oxidu uhelnatého za vysokého tlaku a CVD.
Stěny nanotrubice se skládají (podobně jako grafen) z sp2 uhlíků. MWCNT je snazší vyrobit, první byly vyrobeny už v roce 1952. SWCNT se povedlo vyrobit až v roce 1993.
Pomocí elektronového mikroskopu bylo zjištěno, že lze uhlíkové nanotrubice využít při konstrukci nanotranzistorů, které by mohly v některých aplikacích nahradit křemík.
Odkazy
- Semiconductor nanochannels in metallic carbon nanotubes by thermomechanical chirality alteration
- Researchers use electron microscope to turn nanotube into tiny transistor
Grafen
Alotrop uhlíku tvořený šestičlennými cykly uspořádanými do planárních vrstev uhlíku (sp2 hybridizace). Byl objeven poměrně nedávno, v roce 2010 byla udělena Nobelova cena za fyziku za objev dvourozměrného materiálu grafenu.
U grafenu je pozoruhodná rychlost pohybu elektronů, ta se blíží rychlosti světla, tzn. že se elektrony chovají jako by neměly vlastní hmotnost. To je jeden z důvodů, proč v současnosti patří grafen mezi velmi perspektivní materiály. Mimo jiné by mohl mít i supravodivé vlastnosti.[7]
Odkazy
- Graphene Photosensor is 1000x More Sensitive – fotosenzor z grafenu s velmi vysokou citlivostí
- 3D graphene: Solar cells‘ new platinum?
- Graphene oxide based low cost battery
- Graphene can host exotic new quantum electronic states at its edges – New approach to use of 2-D carbon material opens up unexpected properties, could unleash new uses.
- Electroanalysis – Special Issue: Electrochemistry of Graphene
- Ďábelsky elastické vlákno z oxidu grafenu
- Graphene’s sleeping superconductivity awakens
- Praktické využití materiálů založených na grafenu
- Jeden svět nestačí: Podivuhodný grafen míří do vesmíru — Experimenty evropských badatelů a Evropské kosmické agentury ESA potvrdily, že grafenu je souzeno prorazit i ve vesmírném prostoru. Dnes si jenom obtížně představíme, k čemu všemu ho tam lidé nejspíš použijí.
- 20 let s grafenem – pěkný článek v časopisu Vesmír
Graphulleren
Na začátku roku 2023 byla publikována příprava nové alotropní modifikace, graphullerenu, jde o klece fullerenu C60 propojené vazbami C-C.
Odkazy
- Grafulleren – další supermateriál na bázi uhlíku objeven
- Move over, graphene. There’s a new super-material in town: Graphullerene
- Newly discovered form of carbon is graphene’s ‚superatomic‘ cousin
- A few-layer covalent network of fullerenes
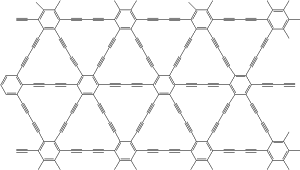
Graphyn
Graphyn byl teoreticky předpovězen v roce 1987 Baughmanem. Jde o struktury tvořené uhlíky v hybridizaci sp1 a sp2. Graphyn vytváří monoatomické vrstvy. V budoucnu by mohl sloužit ke konstrukci tranzistorů pracujících na velmi vysokých frekvencích.
Odkazy
- Lu, H.; Li, S.D. J. Mater. Chem. C 2013, 1, 3677-3680, DOI: 10.1039/c3tc30302k;Two-dimensional carbon allotropes from graphene to graphyne
- Yin, W.J.; Xie, Y.E.; Liu, L.M.; Wang, R.Z.; Wei, X.L.; Lau, L.; Zhong, J.X.; Chen, Y.P. J. Mater. Chem. A 2013, 1, 5341-5346, DOI: 10.1039/c3ta00097d. R-graphyne: a new two-dimensional carbon allotrope with versatile Dirac-like point in nanoribbons
- Carbyne from first principles: Chain of C atoms, a nanorod or a nanorope?
Graphdiyn
Graphdiyn má podobnou strukturu jako graphyn, jen je doplněno o diacetylenové můstky. Připraven byl na měděném substrátu cross-couplingem hexaethynylbenzenu.
Odkazy
- Li, G.; Li, Y.; Liu, H.; Guo, Y.; Li, Y.; Zhu, D. Chemm. Comun. 2010, 46, 3256-3258, DOI: 10.1039/B922733D. Architecture of graphdiyne nanoscale films.
- Ivanovskii, A.L. Progr. Solid State Chem. 2013, 41, 1-19, DOI: 10.1016/j.progsolidstchem.2012.12.001; Graphynes and graphdyines
- Artificial Carbon Graphdiyne: Status and Challenges in Nonlinear Photonic and Optoelectronic Applications
Skelný uhlík

Tyčinka ze skelného uhlíku. Zdroj: commons.wikimedia.org Skelný uhlík není alotropem uhlíku, ale i tak jej sem zařadím. Je to uhlík, který má vlastnosti grafitu a zároveň se blíží svými vlastnostmi sklu a keramice. Má velmi vysokou teplotní odolnost, tvrdost 7 podle Mohsovy stupnice, nízkou hustotu, nízký odpor k vedení elektrického proudu i tepla a vysokou chemickou odolnost. Poprvé byl připraven v 50. letech 20. století Bernardem Redfernem v UK. Využívá se v elektrochemii a jako materiál pro kelímky na vysokoteplotní procesy.
Tlakový skelný uhlík
Tlakový skelný uhlík (Compressed Glassy Carbon) byl poprvé popsán roku 2017, výroba spočívala ve stlačení a zahřátí skelného uhlíku na 250 GPa a 1000 °C.[2] Struktura tohoto materiálu je kombinací struktur diamantu (tetraedrický sp3 uhlík) a grafenu (planární sp2 uhlík). Díky vysokotlaké přípravě nedošlo ke vzniku monokrystalického materiálu, ale výsledný materiál byl složen z nanokrystalických domén.
Vlastnosti tohoto materiálu jsou opravdu velmi zajímavé, vykazuje vysokou elastičnost, pevnost a je velmi lehký. Pokud se podaří zlevnit a zjednodušit výrobu, tak se s ním možná v budoucnu budeme setkávat velmi často.
Odkazy
- Glassy carbon na wikipedii
- Compressed glassy carbon: An ultrastrong and elastic interpenetrating graphene network
Exotické alotropy uhlíku
C18
V roce 2019 byla publikována příprava nového, cyklického alotropu C18. Byl připraven syntézou z molekuly C24O6 a charakterizován pomocí AFM.[1,2]

Struktura C18 Odkazy
- An sp-hybridized molecular carbon allotrope, cyclo[18]carbon
- Pán uhlíkových prstenů: Materiáloví vědci dosáhli legendárního průlomu
Navigace
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 H He Li Be B C N O F Ne Na Mg Al Si P S Cl Ar K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Kr Rb Sr Y Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te I Xe Cs Ba La Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po At Rn Fr Ra Ac Rf Db Sg Bh Hs Mt Ds Rg Cn Nh Fl Mc Lv Ts Og Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No Lr
jen malá připomínka, v názvu „Graphydyin“ máte chybu v názvosloví, podle názvosloví je to Graphydiyn (přehození i-ý) předpona di- a koncovka alkynů -yn…
Díky, opraveno.