Tato metoda redoxní odměrné analýzy využívá oxidační vlastnosti bromičnanu draselného, KBrO3. V kyselém prostředí je redukován až na bromid:
BrO3– + 6 H+ + 6 e– ⇄ Br– + 3 H2O
Jakmile je analyt vyčerpán, reaguje nadbytečný bromičnan se vzniklým bromidem za uvolnění elementárního bromu, tím dojde k zabarvení roztoku do žluta. Nemusíme tedy při titraci využívat indikátor.
BrO3– + 5 Br– + 6 H+ → 3 Br2 + 3 H2O
Pro přesnější detekci bodu ekvivalence se přidává metyloranž nebo metylčerveň, které reagují se vznikajícím bromem a dochází k odbarvení roztoku.
Základní látkou je bromičnan draselný, který je možné navážit velmi přesně, proto není nutné odměrný roztok faktorizovat.
Příklady stanovení
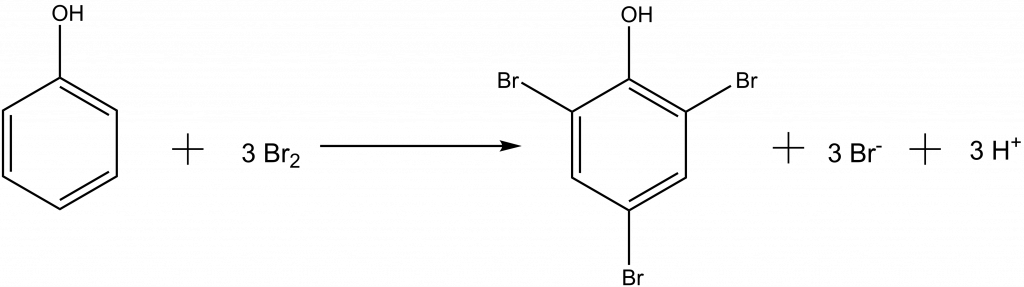
Bromátometrií lze stanovit koncentraci arsenitých a antimonitých iontů, ale také organické sloučeniny, např. fenolu.
3 As3+ + BrO3– + 6 H+ → 3 As5+ + Br– + 3 H2O
3 Sb3+ + BrO3– + 6 H+ → 3 Sb5+ + Br– + 3 H2O
Nepřímá titrace
Fenol se stanovuje nepřímou titrací, k analytu přidáme nadbytek bromidu a známý nadbytek bromičnanu. Nezreagovaný brom pak titrujeme jodometricky.
Další kapitoly
- České chemické názvosloví
- Platné číslice a měření
- Základní chemické zákony
- Důležité veličiny a vztahy v chemii
- Výpočet stechiometrického vzorce
- Chemické rovnice a stechiometrické výpočty
- Koncentrace roztoků
- Rozpustnost, součin rozpustnosti
- Stavba atomu
- Periodická tabulka prvků a periodicita vlastností
- Chemická vazba
- VSEPR
- Komplexní sloučeniny
- Magnetické vlastnosti látek
- Termodynamika
- Chemická rovnováha
- Skupenské stavy látek
- Fázové rovnováhy
- Teorie kyselin a zásad
- pH, aktivita roztoku
- Elektrochemie
- Symetrie molekul
- Laboratorní technika
- Lineární regrese
- Jednotky tlaku
- Jednotky teploty
- Mohsova stupnice tvrdosti minerálů
- Odkazy
- Prezentace k semináři z obecné chemie