Mangan, Mn, je kov ze 7. skupiny PSP. Je to velmi světle šedý, paramagnetický a tvrdý kov. Využívá se jako součást slitin a v pigmentech.
| Atomové číslo | 25 | Počet stabilních izotopů | 1 |
| Atomová hmotnost | 54,938 | Elektronová konfigurace | [Ar] 3d5 4s2 |
| Teplota tání [°C] | 1246 | Teplota varu [°C] | 2061 |
| Elektronegativita | 1,54 | Hustota [g.cm-3] | 7,21 |
Kovový mangan reaguje zvolna s vodou a dobře se rozpouští v kyselinách. Na vzduchu se oxiduje až za vyšších teplot za vzniku Mn3O4. Vytváří sloučeniny ve velkém množství oxidačních čísel, +I až +VII, všechny jeho sloučeniny jsou barevné.
Izotopy
Mangan je téměř monoizotopický, přírodní kov se skoro ze 100 % skládá z izotopu 55Mn a stopových množství radioizotopu 53Mn s poločasem přeměny 3,7 . 106 let, elektronovým záchytem se přeměňuje na 53Cr. Kromě jediného stabilního izotopu známe i 26 radioizotopů.
| Izotop | Zastoupení | Poločas přeměny |
| 52Mn | – | 5,591 dne |
| 53Mn | stopové | 3,7 . 106 let |
| 54Mn | – | 312,081 dne |
| 55Mn | 100 % | stabilní |
| 56Mn | – | 2,58 hodin |
53Mn
Vzniká v atmosféře interakcí s kosmickým zářením, přeměňuje se elektronovým záchytem do základního stavu 53Cr.[5,6]
$$^{53}_{25}\textrm{Mn}\ \rightarrow\ ^{53}_{24}\textrm{Cr}$$
Využívá se v geochemii a kosmochemii, např. byl pomocí něj dokázán mimozemský původ prachových částic v hluboko uložených vrstvách antarktického sněhu.
54Mn
Poločas přeměny 312,03 dne, elektronovým záchytem do excitovaného stavu 54Cr a následně deexcituje emisí fotonu o energii 835 keV.
$$^{54}_{25}\textrm{Mn}\ \rightarrow\ ^{54}_{24}\textrm{Cr}$$
Připravuje se v jaderném reaktoru ostřelováním železa rychlými neutrony:
$$^{54}_{26}\textrm{Fe}\ +\ ^1_0\textrm{n}\ \rightarrow\ ^{54}_{25}\textrm{Mn}\ +\ ^1_1\textrm{p}$$
Využívá se ke studiu chování manganu v životním prostředí.
56Mn
Poločas přeměny 2,58 hodin, přeměnou β− na 56Fe. Následnou deexcitací vyzáří 10 fotonů o energiích v rozmezí 846–3369 keV.
$$^{56}_{25}\textrm{Mn}\ \rightarrow\ ^{56}_{26}\textrm{Fe}\ +\ ^{\ \ 0}_{-1}\beta^-$$
Připravuje se v reaktoru ozařováním burelu (MnO2) neutrony.
$$^{55}_{25}\textrm{Mn}\ +\ ^1_0\textrm{n}\ \rightarrow\ ^{56}_{25}\textrm{Mn}\ +\ \gamma$$
Vzhledem k výhodnému poločasu přeměny a uvolňovanému záření se využívá ke sledování pohybu surovin v průmyslových procesech.
Využití
Hlavní využití manganu je ve výrobě oceli. Ocelářský průmysl využívá slitinu ferromangan, která obsahuje až 80 % manganu. Vyrábí se redukcí směsi oxidu manganičitého a železitého koksem.

Kromě kovového manganu má velké využití i oxid manganičitý (burel) a manganistan draselný. Manganistan draselný se využívá jako oxidační činidlo a odměrný roztok v manganometrii.
Chemické vlastnosti
Je poměrně hodně zastoupen v zemské kůře, okolo 0,1 %. Vyskytuje se společně s rudami železa. Mezi nejdůležitější minerály manganu patří pyroluzit (burel, MnO2), hausmannit (Mn3O4) a rhodochrozit (MnCO3).
Sloučeniny manganu
Mangan vytváří běžně sloučeniny v oxidačních číslech od II do VII (mimo V), ale známe jeho sloučeniny v oxidačních stavech od -III až po VII.
Sloučeniny MnI
Reakcí práškového manganu s roztokem NaCN v anaerobních podmínkách dochází k oxidaci vodou a vzniká komplex Na5[Mn(CN)6]. V tomto oxidačním stavu jsou známy i další komplexy, jejich stabilizace je většinou zajištěna stericky náročnými (objemnými) ligandy.
Sloučeniny MnII
Manganaté sloučeniny se připravují nejčastěji z burelu (MnO2), jsou to většinou bezbarvé nebo slabě růžové látky. Většina manganatých komplexů je vysokospinová. Oxid manganatý (MnO) je zelená látka, kterou lze připravit tepelným rozkladem octanu manganatého, je antiferoangnetický a má strukturu NaCl.
Sloučeniny MnIII
Tyto sloučeniny jsou silná oxidační činidla a ochotně disproporcionují na MnII a MnIV. V pevném stavu jsou mají fialovo-červené zbarvení.
Sloučeniny MnIV
Asi nejznámější sloučeninu čtyřmocného manganu je oxid manganičitý (burel, MnO2), který je polymorfní a většina jeho modifikací je nestechiometrická. Koordinační chemie je poměrně chudá, známe jednojaderné komplexy, např. [MnF6]2- a [Mn(CN)6]2- i složitější částice jako je [MnW5O20]6-.
Sloučeniny MnV
Tento oxidační stav není příliš běžný, můžeme se s ním setkat např. při rozpouštění MnO2 v tavenině dusitanu sodného, kdy vzniká MnO43-.[4]
MnOCl3 lze připravit reakcí manganistanu draselného s chloroformem v prostředí kyseliny chlorsírové. Je tepelně nestabilní, v kyselém nebo neutrálním prostředí disproporcionuje.
Sloučeniny MnVI
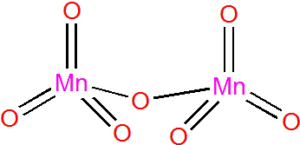
Binární halogenidy nejsou známy. Redukcí KMnO4 pomocí SO2 za nízké teploty vzniká hnědá kapalina MnO2Cl2.
Velkou skupinou látek v tomto oxidačním stupni jsou manganany (SO42-, tyto soli jsou zpravidla tmavě zelené a připravují se zahříváním MnO2 s hydroxidy alkalických kovů. Jsou nestálé a ochotně podléhají disproporcionaci na manganistan a oxid manganičitý.
Sloučeniny MnVII
V tomto oxidačním stavu nacházíme jednu z nejznámějších sloučenin manganu – manganistan draselný (hypermangan, KMnO4), který se využívá jako desinfekční činidlo a v chemii jako oxidační činidlo v syntéze i v odměrné analýze (manganometrie). Je to fialová, krystalická látka, velmi dobře rozpustná ve vodě. Ročně se ho vyrobí asi půl milionu tun, vyrábí se z minerálu MnO2 zahříváním na vzduchu s KOH a následnou elektrolytickou oxidací vzniklého mangananu. Manganistanový ion je v souladu s teorií VSEPR tetraedrický, délka vazby Mn-O je 163 pm.
Reakcí manganistanu draselného s koncentrovanou kyselinou sírovou vzniká kyselina manganistá (HMnO4), která je ihned dehydratována na zelený oxid manganistý (Mn2O7). Ten je za laboratorní teploty silně výbušný a prudce reaguje i se stopami organických látek.
Reakci oxidu manganistého s ethanolem můžete vidět na následujícím videu z commons:
Reakcí manganistanu s kyselinou fluorosírovou, resp. chlorosírovou za nízké teploty získáme oxid-halogenidy MnO3F, resp. MnO3Cl.
NMR
Mangan je (téměř) monoizotopický prvek, v NMR se tedy využívá izotop 55Mn. Jedná se o kvadrupolární, vysoce citlivé jádro. V případě symetrického okolí, poskytuje relativně úzké signály. Standardem je roztok KMnO4 v D2O.
| Spin | 5/2 |
| Zastoupení v přírodě [%] | 100 % |
| Citlivost vzhledem k 1H | 0,179 |
| Citlivost vzhledem k 13C | 1050 |
| Rozsah chemických posunů | -3000 – 0 ppm |
| Rezonanční frekvence v poli 1 T | 10,5763 |
| Jaderný magnetický moment | +3,46872 |
Chemické posuny
| KMnO4 | 0 |
| MnVII | 0 – -100 |
| MnI | -1000 – -1600 |
| Mn0/Mn-I | -1900 – -3000 |
Literatura
- Mangan na české wikipedii
- Mangan na anglické wikipedii
- 55Mn NMR
- The Formation of Manganese(V) In Molten Sodium Nitrite
- Isotopes of manganese
- HÁLA, Jiří. Radioaktivní izotopy. Tišnov: Sursum, 2013. ISBN 978-80-7323-248-1.
Navigace
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| H | He | ||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr |
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe |
| Cs | Ba | La | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| Fr | Ra | Ac | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |
| Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu |
| Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr |
3 Replies to “Mangan”