Vzácné plyny jsou prvky 18. skupiny periodické soustavy prvků. Až do roku 1962 nebyly známy žádné sloučeniny těchto plynů, kdy byla provedena reakce xenonu s fluoridem platinovým, která poskytla XePtF6. Inspirací pro tuto reakci byla příprava sloučeniny O2PtF6, protože ionizační energie O2 je podobná ionizační energii xenonu.[1] Krátce poté byla připravena první binární sloučenina, fluorid xenoničelý (XeF4), zahříváním směsi xenonu s fluorem.[2]
Sloučeniny helia
Helium je nejmíň reaktivní prvek, jeho první ionizační energie je 24,57 eV je nejvyšší. Odpuzování mezi atomy helia a jinými prvky lze překonat vysokým tlakem. Tak lze připravit např. fázi Na2He, která je stabilní při tlaku nad 113 GPa a tvoří krystalickou mřížku, i když helium nevytváří chemickou vazbu.[6] Fáze byla připravena v diamantové cele, do které byl vložen tenký plátek sodíku a zbylý prostor byl naplněn plynným heliem. Tlak v cele byl monitorován pomocí Ramanovy spektroskopie a průběh procesu byl monitorován synchrotronovou RTG difrakcí.
Dále jsou známy klathráty helia s ledem a také endohedrální deriváty fullerenů (He@C60 a He2@C60).
Sloučeniny neonu
Dosud není známá žádná sloučenina neonu, pouze molekulární ionty obsahující neon, např. NemHen+, TiNe+, ZrNe2+, NbNe2+ a další.[3]
Sloučeniny argonu
První připravenou sloučeninou argonu byl komplex s karbonylem wolframu, ArW(CO)5. Ten byl připraven roku 1975. V roce 2000 byl připraven ArHF reakcí fluorovodíku s argonem na povrchu iodidu cesného při teplotě 8 K (-265 °C). Tato sloučenina je stabilní pouze do teploty 17 K.
Sloučeniny kryptonu
Nejjednodušší sloučeninou kryptonu je KrF2, ten ovšem nelze připravit syntézou z prvků, musí se používat náročnější postupy, např. syntéza v elektrickém výboji, který zajišťuje atomizaci fluoru.[4] Fluorid kryptonatý vytváří soli se silnými Lewisovými kyselinami. Tyto soli obsahují kationty KrF+ nebo Kr2F3+.
V roce 1963 byla popsána příprava KrF4 působením elektrického výboje na směs fluoru a kryptonu, později se ale ukázalo, že jde opět o KrF2.
Reakcí KrF2 s [HC≡NH][AsF6] při teplotě −50 °C lze připravit kationt s vazbou Kr-N — [HC≡N–Kr–F]+.
V roce 2020 byla publikována práce popisující první přípravu sloučeniny FKrCF.
Sloučeniny xenonu
Jak už bylo uvedeno výše, první sloučeninou xenonu byl XePtF6 připravený reakcí xenonu s PtF6.[5]
Xe + PtF6 → XePtF6
Dále známe poměrně velké množství sloučenin xenonu, halogenidy XeF2, XeF4 a XeF6. Oxidy a oxohalogenidy: XeO2, XeO3, XeO4, XeOF2, XeOF4, XeO2F2, atd.
V roce 2020 byla publikována práce popisující první přípravu sloučeniny FXeCF.
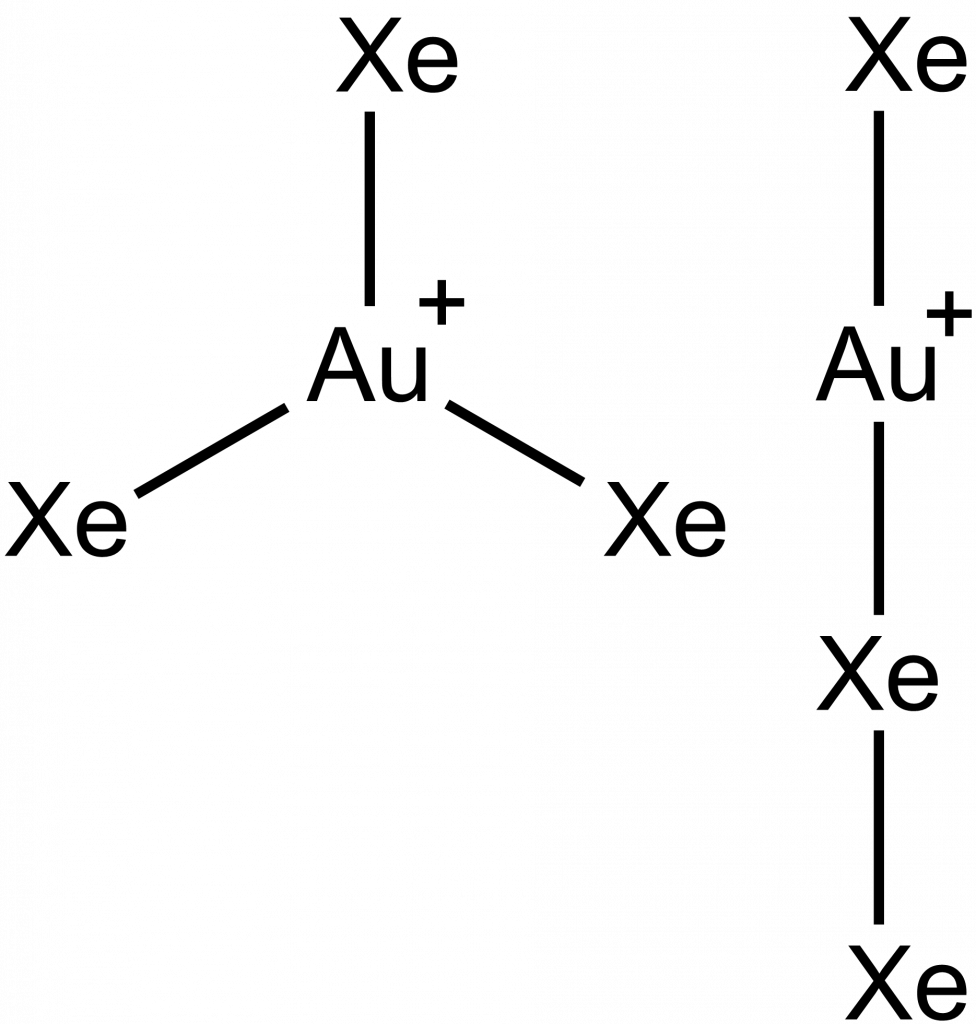
Laserovou ablací zlata v atmosféře plynného xenonu lze získat ionty obsahující vazbu Xe-Au. Pomocí hmotností spektrometrie bylo zjištěno, že jejich složení odpovídá vzorci AuXe3+. Tomu odpovídají dvě možné struktury, pomocí infračervené spektroskopie a DFT výpočtů bylo určeno, že se jedná o lineární izomer.[7]
Sloučeniny radonu
Radon je radioaktivní prvek, což omezuje možnosti studia. Známými sloučeninami jsou fluorid radonatý (RnF2) a oxid radonový (RnO3).
Literatura
- Xenon hexafluoroplatinate Xe+[PtF6]−
- Xenon Tetrafluoride
- On the stability of cationic complexes of neon with helium – solving an experimental discrepancy
- The chemistry of krypton
- Noble gas compounds and chemistry: a brief review of interrelations and interactions with fluorine-containing species
- A stable compound of helium and sodium at high pressure
- Spectroscopic evidence of a Xe–Xe bond in the linear Xe2Au+Xe ion