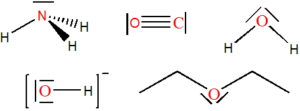
Pojmy kyselina a zásada jsou v chemii známy už velmi dlouhou dobu, ale jejich definice se s časem měnila a rozvíjela. V současnosti existuje několik různých definic kyselin a zásad. Disociačních konstanty vybraných kyselin a zásad jsou uvedeny zde.
Arrheniova teorie
Kyseliny ve vodném roztoku uvolňují částici H+, zatímco zásady částici OH–.
V roce 1887 definoval Arrhenius kyseliny a zásady jako elektrolyty, tedy látky schopné v roztoku disociovat na ionty. Kyseliny při disociaci uvolňují proton, tedy ion H+:
HA ↔ H+ + A–
a zásady ion OH–:
BOH ↔ B+ + OH–
Tato definice byla postupně rozšiřována, ale i přesto je už dnes považována za zastaralou.
Brönstedova-Lowryho teorie
Kyseliny vystupují jako donor H+, zásady jako akceptor H+.
Byla formulována roku 1923, základem této teorie je autoprotolýza vody, tj. vzájemná ionizace dvou molekul vody:
H2O + H2O ↔ H3O+ + OH–
V tomto procesu vystupuje jedna molekula vody jako kyselina, když disociuje na ionty H+ a OH–, H+ ihned reaguje s jinou molekulou vody (bází) za vzniku H3O+. Na rozdíl od Arrheniovy teorie, uvažujeme solvataci vzniklých iontů molekulami rozpouštědla. Rozpouštědlem nemusí být jen voda, podobné procesy probíhají např. v kapalném amoniaku (ne vodném roztoku):
NH3 + NH3 ↔ NH4+ + NH2–
Kyselinu tedy můžeme definovat jako molekulu, která je schopná odštěpit proton (donor) a zásadu jako molekulu, která tento proton dokáže přijmout (akceptor).
H2SO4 + HNO3 ↔ HSO4– + H2NO3+
Zde vystupuje kyselina sírová jako kyselina a kyselina dusičná jako zásada. Odpovídající páry iontů, lišící se o jeden proton nazýváme konjugované páry:
H2SO4 – HSO4–
HNO3 – H2NO3+
Z této rovnice vidíme, že označení látky jako kyseliny nebo zásady je nepřesné, pokud neuvedeme druhého reakčního partnera z acidobazické reakce. Zde vystupuje kyselina dusičná jako zásada vůči kyselině sírové.
Solvoteorie kyselin a zásad
Kyselina zvyšuje koncentraci kationtů produkovaných autoionizací a zásada zvyšuje koncentraci příslušných aniontů.
Byla formulována roku 1954 Guttmannem a Lindquistem, je obecnější než Brönsted-Lowryho teorie. Vychází z autoionizace rozpouštědla. Kyselinu definuje jako látku, která zvyšuje koncentraci kationtů produkovaných autoionizací a zásadu jako látku, která zvyšuje koncentraci příslušných aniontů.
V prostředí kapalného amoniaku
NH3 + NH3 ↔ NH4+ + NH2–
je kyselinou např. NH4Cl
NH4Cl ↔ NH4+ + Cl–
a zásadou např. amidy alkalických kovů:
NaNH2 ↔ Na+ + NH2–
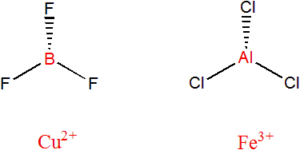
Lewisova teorie
Kyselina je akceptorem elektronového páru, zásada je jeho donorem.
Patří mezi obecnější teorie kyselin a zásad, byla formulována již roku 1923 Gilbertem Newtonem Lewisem, přijetí se ovšem dočkala až po roce 1938. Lewisova zásada je definována jako nukleofilní částice, čili částice schopná poskytnout nevazebný elektronový pár.
Kyselina pak jako elektrofil, čili částice schopná tento elektronový pár přijmout (musí mít volný orbital). Může se jednat o elektronově deficitní molekuly, ionty kovů, příp. sloučeniny prvků, kde je možné zvýšení koordinačního čísla, např. SiF4.
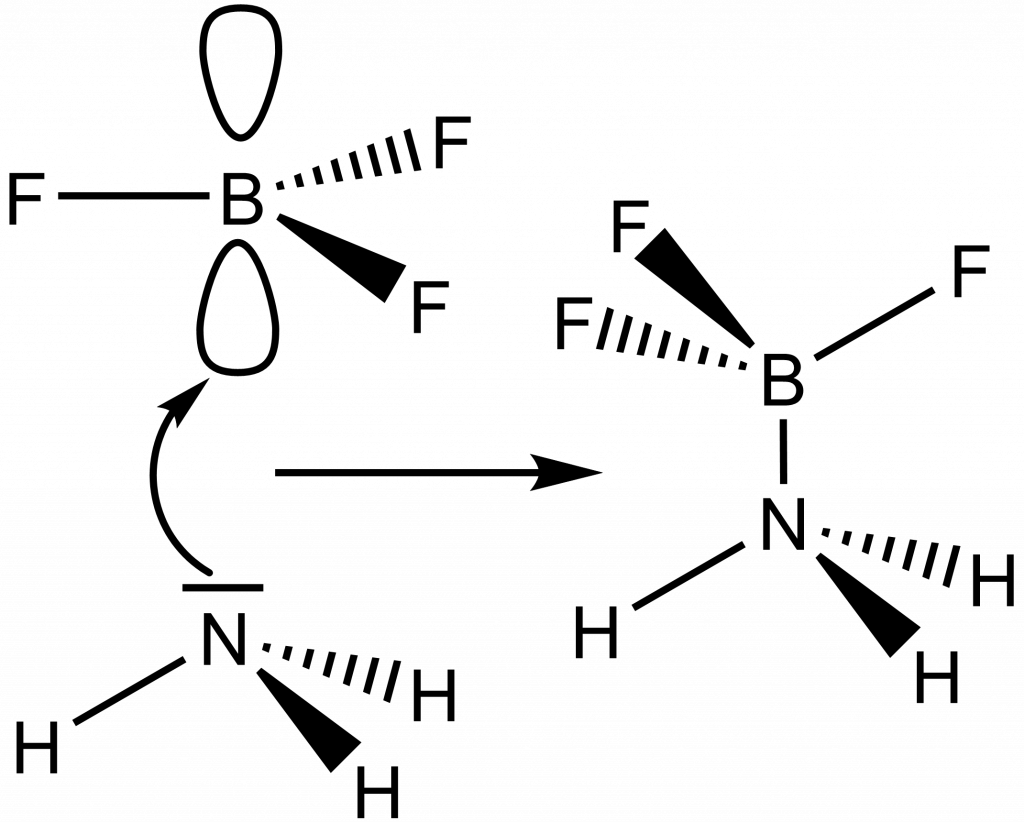
Reakce kyseliny se zásadou pak odpovídá tvorbě koordinační vazby, např. vznik aduktu amoniaku s fluoridem boritým:
|NH3 + BF3 ↔ H3N−BF3
Fluorid boritý má volný p-orbital kolmý na rovinu molekuly. Finální adukt má tvar dvou pyramid spojených vrcholem.
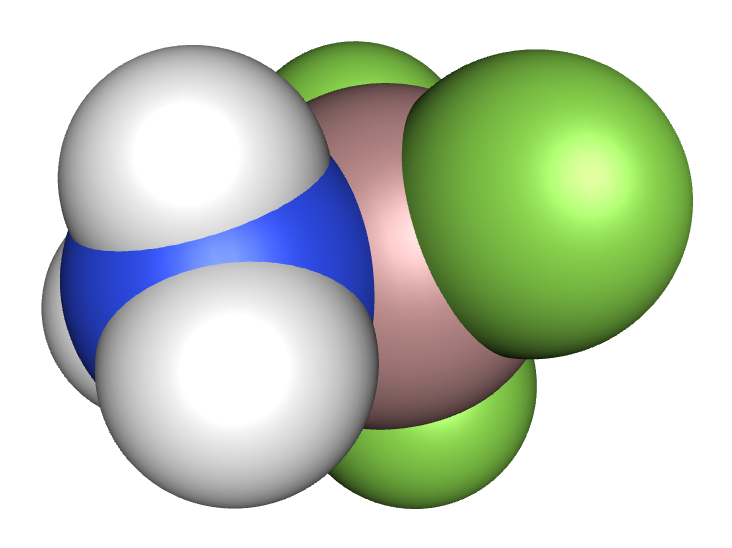
Dalším příkladem je vznik hexaaquahlinitého kationtu ve vodném roztoku hlinitých solí:
Al3+ (aq) + 6 H2O (l) ↔ [Al(H2O)6]3+ (aq)
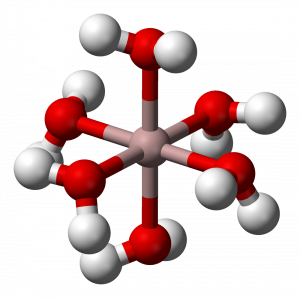
Tato teorie tedy umožňuje určení role v acidobazických procesech i u aprotických systémů.
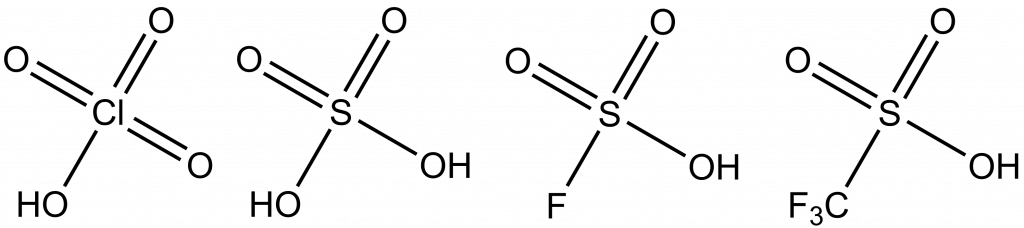
Superkyseliny
Jako superkyseliny se označují kyseliny silnější než koncentrovaná kyselina sírová. K jejich popisu se používá Hammettova kyselostní funkce (H0). Lze ji zjistit pomocí interakce superkyseliny s velmi slabou bazí:
$$H_0 = pK_{BH^+} + \log \frac{[B]}{[BH^+]} = -\log(a_{H^+} \frac{\gamma_B}{\gamma_{BH^+}})$$
| Kyselina | H0 |
| Kyselina sírová | -12,0 |
| Kyselina chloristá | -12,78 |
| Kyselina trifluormethansulfonová | -14,1 |
| Fluorovodík | -15,1 |
| Kyselina fluorsírová | -15,1 |
| Magická kyselina | -19,2 |
| Kyselina hexafluoroantimoničná | -21 – -23 |
Superkyseliny odvozené od antimonu jsou probrány v příslušném článku.
Literatura
Další kapitoly
- České chemické názvosloví
- Platné číslice a měření
- Základní chemické zákony
- Důležité veličiny a vztahy v chemii
- Výpočet stechiometrického vzorce
- Chemické rovnice a stechiometrické výpočty
- Koncentrace roztoků
- Rozpustnost, součin rozpustnosti
- Stavba atomu
- Periodická tabulka prvků a periodicita vlastností
- Chemická vazba
- VSEPR
- Komplexní sloučeniny
- Magnetické vlastnosti látek
- Termodynamika
- Chemická rovnováha
- Skupenské stavy látek
- Fázové rovnováhy
- Teorie kyselin a zásad
- pH, aktivita roztoku
- Elektrochemie
- Symetrie molekul
- Laboratorní technika
- Lineární regrese
- Jednotky tlaku
- Jednotky teploty
- Mohsova stupnice tvrdosti minerálů
- Odkazy
- Prezentace k semináři z obecné chemie