Zlato, Au, je těžký (hustota 19,3 g.cm-3), měkký kov s výbornou tepelnou a elektrickou vodivostí. Dříve bylo významným šperkařským kovem a platidlem. V současnosti nachází i velké využití v mikroelektrotechnice.
| Vlastnosti zlata | |||
| Atomové číslo | 79 | Počet stabilních izotopů | 1 |
| Atomová hmotnost | 196,97 | Elektronová konfigurace | [Xe] 4f14 5d10 6s1 |
| Teplota tání [°C] | 1064,18 | Teplota varu [°C] | 2856 |
| Elektronegativita | 2,54 | Hustota [g.cm-3] | 19,320 |
Zlato je ušlechtilejší než měď a stříbro, lze to demonstrovat pomocí hodnoty elektrodového potenciálu:
| Cu2+/Cu | 0,337 |
| Ag+/Ag | 0,80 |
| Au+/Au | 1,83 |
Izotopy
Známe izotopy zlata v rozmezí 170Au až 205Au, stabilní je pouze 197Au. Nejdůležitější nestabilní izotopy jsou shrnuty v následující tabulce.
| Izotop | Poločas rozpadu [dny] | Produkt rozpadu |
|---|---|---|
| 195Au | 186,1 | 195Pt |
| 196Au | 6,183 | 196Pt nebo 196Hg |
| 198Au | 2,695 | 198Hg |
| 199Au | 3,169 | 199Hg |
198Au
Praktické využití nachází izotop 198Au, který se využívá v ropném průmyslu k detekci netěsností ventilů a potrubí, měření doby průchodu různých látek potrubím. K těmto účelům se využívá látka 198AuCl4– v toluenovém roztoku. Koloidní roztok 198Au se používal v medicíně pro léčení revmatické artritidy kolenního kloubu, tento roztok se připravoval redukcí HAuCl4 glukózou v přítomnosti želatiny.
Výskyt a získávání
V zemské kůře je vzácné, ale nachází se převážně v ryzí formě. V mořské vodě je jeho koncentrace průměrně 1 mg zlata na tunu mořské vody, to je sice malá koncentrace, ale vzhledem k množství mořské vody jde o obrovské množství.

Zlato se dříve získávalo z říčních písků, ale tyto zdroje jsou již vyčerpány. Dnes se získává převážně ze zlatonosných hornin. Koncentrace zlata je velmi nízká, řádově v ppm, proto se musí izolovat buď amalgamací nebo reakcí s kyanidem.
První možnost využívá tvorbu amalgámu při styku s rtutí a následným oddestilováním rtuti. To je samozřejmě ekologicky velmi problematické, protože nejjednodušší způsob oddělení rtuti a zlata je zahřívání na otevřeném ohni, kdy rtuť těká do ovzduší.[8]
Druhý způsob je založen na oxidaci v přítomnosti kyanidu. Vzniklý komplex je sorbován na uhlík a následně izolován a redukován kovovým zinkem.
4 Au + 8 NaCN + O2 + 2 H2O → 4 Na[Au(CN)2] + 4 NaOH
2 Na[Au(CN)2] + Zn → Na2[Zn(CN)4] + 2 Au
Těžba a zpracování zlatonosných rud je zachycena na následujícím videu:
Využití
Hlavní využití zlata je v ekonomice a šperkařství. Čistota zlata v klenotnictví se udává v karátech (kt).[6] Čisté zlato má 24 kt. Ryzost je dána vztahem:
$$X = \frac{m_{Au}}{m}$$
| Karáty | 9 | 14 | 18 | 21,6 | 22 | 23,6 | 24 |
| Ryzostní číslo | 5 | 4 | 3 | 2 | 1 | 0 | 00 |

V roce 2000 se spotřebovalo 280 tun zlata v elektronických aplikacích, spotřeba v této oblasti neustále roste.[7] Zlato se využívá hlavně na pokovování konektorů, čímž se snižuje jejich odpor a zvyšuje odolnost vůči korozi. Také se používá jako vodič v integrovaných obvodech a CPU.

Zlato má velmi dobrou odrazivost v oblasti viditelného a infračerveného záření, čehož se využívá při konstrukci optických prvků, např. pro IR spektroskopii.
Zlato také tvoří povrchovou vrstvu zrcadla vesmírného dalekohledu Jamese Webba (JWST), který odstartoval 25. prosince 2021 a do svého působiště v libračním bodu L2 (cca 1,5 milionu km od Země) by měl dorazit koncem ledna. Zrcadla má vyrobena z beryllia, které je potažené vrstvou zlata. Beryllium se využívá proto, že je dostatečně mechanicky odolné a zároveň lehké. Také má nízký koeficient tepelné roztažnosti.


Chemické vlastnosti
Chemicky je velmi inertní, z běžných kyselin ho rozpouští jen lučavka královská, kdy vzniká tetrachlorozlatitý kation [AuCl4]–. Dále se rozpouští ve rtuti za vzniku amalgámu nebo v přítomnosti kyanidů za vzniku dikyanozlatnanu [Au(CN)2]–.
Zlato je velmi odolné vůči korozi, jeho mechanické vlastnosti je možné zlepšit sléváním s jinými kovy.
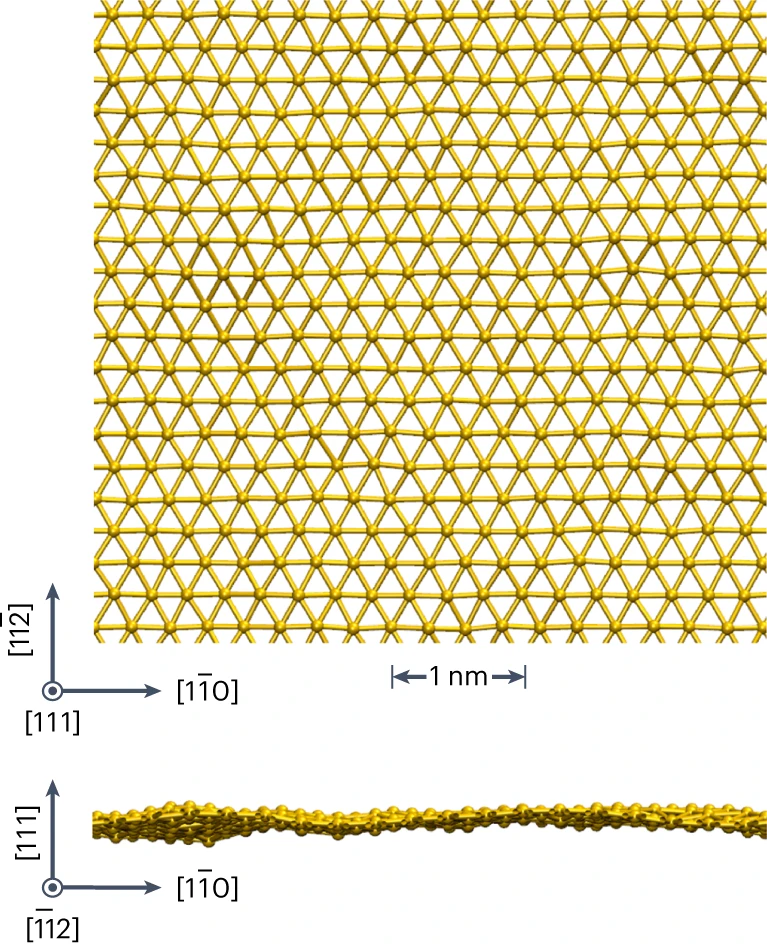
V roce 2019 byla publikována příprava 2D vrstev zlata o tloušťce dvou atomů, jejich katalytická aktivita byla desekrát vyšší než u používaných zlatých nanočástic.[5]
Golden
Poměrně komplikovaným postupem se podařilo připravit 2D vrstvu zlata, tzv. golden (zlaten).[9-12]
NMR
Zlato je monoizotopický prvek, díky kvadrupólovému momentu poskytuje pouze velmi málo intenzivní a široké signály a v praxi se příliš nepoužívá.
| 197Au | |
| Spin | 3/2 |
| Zastoupení v přírodě [%] | 100 % |
| Citlivost vzhledem k 1H | 2,51.10-5 |
| Rezonanční frekvence v poli 1 T | 0,7406 |
| Jaderný magnetický moment | +0,145746 |
Odkazy
- Zlato na české wikipedii
- Zlato na anglické wikipedii
- Zangger, K.; Armitage, I.M. Met Based Drugs 1999, 6, 239-245. Silver and Gold NMR.
- HÁLA, Jiří. Radioaktivní izotopy. Tišnov: Sursum, 2013. ISBN 978-80-7323-248-1.
- Scientists create the world’s thinnest gold
- Co nám říká punc
- Current and future uses of gold in electronics
- Illegal gold mines flood Amazon forests with toxic mercury
- Synthesis of goldene comprising single-atom layer gold
- Goldene: New 2D form of gold makes graphene look boring
- Scientists developed a sheet of gold that’s just one atom thick
- Podivuhodný zlaten je novým želízkem v ohni 2D materiálů
Navigace
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| H | He | ||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr |
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe |
| Cs | Ba | La | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| Fr | Ra | Ac | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |
| Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu |
| Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr |

11 Replies to “Zlato”