Tantal, Ta, je tvrdý, lesklý kov, s výbornými korozivzdornými vlastnostmi. Prvek byl objeven roku 1844 společně s niobem a byl pojmenován podle bájného krále Tantala. Tantalos syn Diův, byl potrestán za vyzrazení tajemství bohů smrtelníkům. Trest spočíval mimojiné v tom, že stál až po bradu ve vodě, ale kdykoliv se pokusil napít, voda klesla. Tak byl odsouzen k věčné žízni. Pojmenování tantalu (jeho objevitelem A. G. Ekebergem) je narážka na to, že ačkoliv je ponořen do kyseliny, nerozpouští se.
| Atomové číslo | 73 | Počet stabilních izotopů | 1 (2) |
| Atomová hmotnost | 180,948 | Elektronová konfigurace | [Xe] 4f14 5d3 6s2 |
| Teplota tání [°C] | 3017 | Teplota varu [°C] | 5458 |
| Elektronegativita | 1,5 | Hustota [g.cm-3] | 16,69 |
V přírodě se vyskytuje vzácně, jeho koncentrace je zhruba 1,7 ppm, a většinou společně s niobem. Nejdůležitějším minerálem je tantalit (Fe,Mn)Ta2O6. Získává se z ložisek v Malajsii a Nigérii jako vedlejší produkt při výrobě cínu.
Izotopy
Tantal má dva stabilní izotopy a známe 35 umělých radioizotopů. Izomer 180mTa je pochopitelně nestabilní, ale zatím se nepodařilo stanovit jeho poločas rozpadu.[4,5] Jde o jedno z mála stabilních jader s lichým počtem protonů i neutronů.
| Izotop | Zastoupení v přírodě [%] |
| 180mTa | 0,012 |
| 181Ta | 99,988 |
180mTa
V roce 2016 bylo měřením prokázáno, že poločas rozpadu bude delší než 4,5.1016 let. Jádro se přeměňuje dvěma mechanismy, elektronovým záchytem a β− rozpadem.[4]
Využití
Využití nachází především v elektronice při výrobě kondenzátorů a výkonových odporů.[3]

Dále je součástí slitin, kde se využívá jeho vysoké teploty tání. Jeho chemické inertnosti za nízkých teplot se využívá i ve slitinách pro medicinální účely. Porézní tantal se využívá jako alternativní materiál pro povrchové úpravy ortopedických implantátů, vytváří vazbu s tvrdými tkáněmi.[6]
Sloučeniny tantalu
Tantal vytváří sloučeniny převážně v oxidačním stavu V, nižší oxidační stavy nejsou tak časté. Je chemicky velmi odolný, nerozpouští se ani v lučavce královské, ale rozpouští se v kyselině fluorovodíkové. Jeho kritická teplota pro přechod do supravodivého stavu je 4,48 K.
| Vzorec | Vzhled | Tt [°C] | Tv [°C] |
|---|---|---|---|
| TaF5 | bílý prášek | 96,5 | 229,5 |
| TaCl5 | bílé krystaly | 216 | 239,4 (rozklad) |
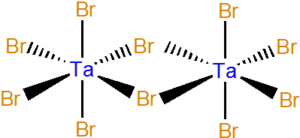
| Ta2Br10 | žlutá pevná látka | 265 | 349 |
| Ta2I10 | černá pevná látka | 543 | |
| Ta2O5 | bílý prášek | 1872 | |
| TaC | hnědý prášek | 3850-3890 | 4780-5470 |
| TaN | černé krystaly | 3090 | |
| TaS2 | černé krystaly | >3000 | |
| TaAl3 | šedý prášek | 1400 | |
| Ta2(OCH2CH3)5 | bezbarvá kapalina | 21 | 145 |
Oxidy
Oxidů tantalu je známo poměrně málo, TaO2 má strukturu rutilu, Ta2O5 vytváří dvě fáze, které mezi sebou přecházejí při teplotě 1355 °C. Kromě toho je znám i TaO se strukturou halitu (NaCl).
NMR
Tantal je prakticky monoizotopický prvek, izotop 181Ta má téměř 100% zastoupení, jeho jaderný spin je 7/2. Má poměrně nízkou citlivost a vysoký kvadrupolární moment. Izotop 180Ta, nebo lépe 180mTa, má velmi vysoký poločas rozpadu. Jeho zastoupení je velice nízké a v praxi se nevyužívá.
| 180Ta | 181Ta | |
| Spin | 9 | 7/2 |
| Zastoupení v přírodě [%] | 0,012 | 99,8 |
| Rezonanční frekvence v poli 1 T | 4,087 | 5,1627 |
| Jaderný magnetický moment | +4,825 | +2,3705 |
| Citlivost vůči 1H | 0,10610 | 0,03744 |
Odkazy
- Tantal na české wikipedii
- Tantal na anglické wikipedii
- Tantalum Capacitor
- Search for the decay of nature’s rarest isotope 180mTa
- Vznik tantalu ve hvězdách
- Applications of Porous Tantalum in Total Hip Arthroplasty
Navigace
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| H | He | ||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr |
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe |
| Cs | Ba | La | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| Fr | Ra | Ac | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |
| Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu |
| Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr |
2 Replies to “Tantal”