Chelatometrie (komplexometrie) je jednou z metod odměrné analýzy. Je založena na tvorbě velmi stabilních komplexních sloučenin, které jsou v roztoku málo disociovány. Stabilita vznikajících komplexů je dána tzv. chelátovým efektem.
Jako odměrné činidlo se nejčastěji využívají roztoky chelatonu 2 a chelatonu 3. Chelaton 2 je kyselina ethylendiamintetraoctová a chelaton 3 je její disodná sůl.
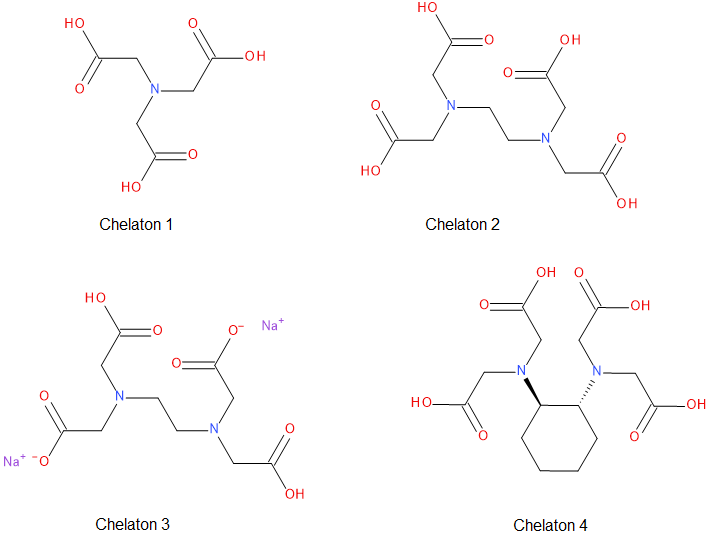
Chelatony jsou výhodné, protože s libovolným iontem kovu vytvářejí komplexy v poměru 1:1, což umožňuje kvantitativní stanovení koncentrace.
M2+ + H4Y → MH2Y + 2 H+
M3+ + H4Y → MHY + 3 H+
M4+ + H4Y → MY + 4 H+

Chelaton 3 se dodává ve formě dihydrátu, který ale nemá přesně definovaný obsah vody. Proto je nutné po přípravě odměrného roztoku stanovit jeho titr. To se dělá např. na navážku velmi čistého bismutu, který rozpustíme v koncentrované kyselině dusičné. Rozpouštění se provádí v odměrné baňce, aby byla zajištěna přesná koncentrace.
Bi + 4 HNO3 → Bi(NO3)3 + NO + 2 H2O
Přímé a nepřímé stanovení
Chelatometrie se využívá ke stanovení koncentrace kationtů Mg, Zn, Cu, Al, Bi, Pb, ale i ke stanovení celkové tvrdosti vody. Pokud kationty reagují s chelatonem rychle, využívá se přímé stanovení. Vzorek je titrován přímo odměrným roztokem chelatonu.
V případě pomalejší reakce, např. u málo rozpustných vápenatých solí, se využívá nepřímé stanovení. Ke vzorku se nejprve přidá nadbytek chelatonu. Po přídavku chelatonu rozpuštěné vápenaté ionty reagují s chelatonem za vzniku rozpustného chelátu, tím dochází k dalšímu rozpouštění vápenatých solí. Nakonec získáme roztok obsahující vápenatý chelát a nezreagovaný podíl odměrného činidla. Ten se ztitruje, např. roztokem ZnSO4.
Indikátory
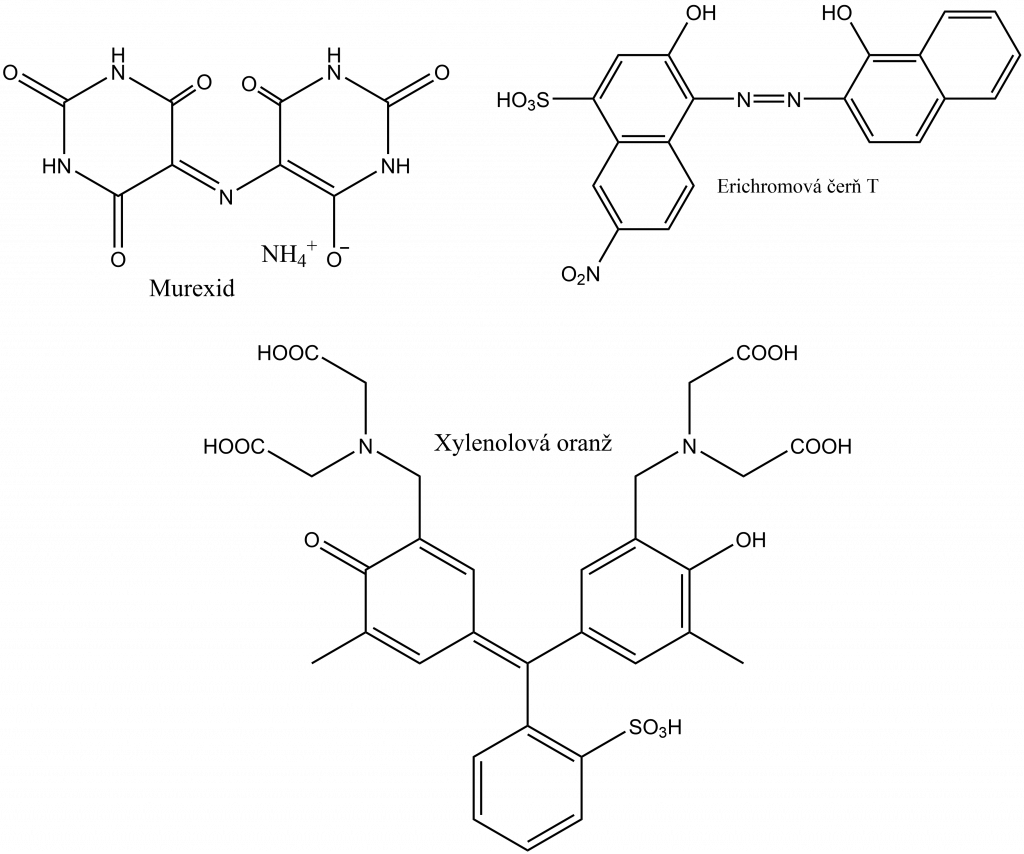
Při titraci se využívají metalochromní indikátory, což jsou organické vícesytné kyseliny, které vytvářejí komplexy se stanovovaným kovem. Tyto komplexy jsou méně stabilní než komplexy kovu s chelatonem. Bod ekvivalence se indikuje změnou barvy. Příkladem takového indikátoru je murexid.

Další kapitoly
- České chemické názvosloví
- Platné číslice a měření
- Základní chemické zákony
- Důležité veličiny a vztahy v chemii
- Výpočet stechiometrického vzorce
- Chemické rovnice a stechiometrické výpočty
- Koncentrace roztoků
- Rozpustnost, součin rozpustnosti
- Stavba atomu
- Periodická tabulka prvků a periodicita vlastností
- Chemická vazba
- VSEPR
- Komplexní sloučeniny
- Magnetické vlastnosti látek
- Termodynamika
- Chemická rovnováha
- Skupenské stavy látek
- Fázové rovnováhy
- Teorie kyselin a zásad
- pH, aktivita roztoku
- Elektrochemie
- Symetrie molekul
- Laboratorní technika
- Lineární regrese
- Jednotky tlaku
- Jednotky teploty
- Mohsova stupnice tvrdosti minerálů
- Odkazy
- Prezentace k semináři z obecné chemie