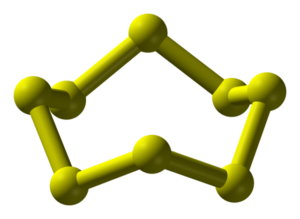
Síra, S, je žlutý nekov, v přírodě poměrně rozšířený. Vyskytuje se v několika alotropních modifikacích, nejběžnější je α-síra, která je tvořena osmiatomovými, cyklickými molekulami.
| Atomové číslo | 16 | Počet stabilních izotopů | 4 |
| Atomová hmotnost | 32,065 | Elektronová konfigurace | [Ne] 3s2 3p4 |
| Teplota tání [°C] | 119,21 | Teplota varu [°C] | 444,6 |
| Elektronegativita | 2,40 | Hustota [g.cm-3] | 2,070 |
Získává se těžbou, protože v přírodě nalézáme síru i v čistém stavu.[6] Ložiska se nacházejí v USA, Mexiku a Polsku. Mimoto se vyskytuje ve formě sloučenin jak anorganických, tak i organických. Nejrozšířenějším minerálem síry je pyrit (FeS2). Dale je síra získávána jako vedlejší produkt při výrobě chalkofilních kovů, např. mědi.
Izotopy
Přírodní síra se skládá ze čtyř stabilních izotopů a jednoho radioizotopu. Dále známe 18 umělých radioizotopů s krátkými poločasy rozpadu.
| Izotop | Poločas rozpadu | Zastoupení [%] |
| 32S | stabilní | 94,99 |
| 33S | stabilní | 0,75 |
| 34S | stabilní | 4,25 |
| 35S | 87,37 dne | stopové |
| 36S | stabilní | 0,01 |
35S
Jádro 35S vzniká interakcí kosmického záření s jádry 40Ar v atmosféře. Uměle se vyrábí ozařováním chloridu draselného neutrony v jaderném reaktoru:[7]
$$^{35}_{17}\textrm{Cl}\ +\ ^1_0\textrm{n}\ \rightarrow\ ^{35}_{16}\textrm{S}\ +\ ^1_1\textrm{p}$$
Ozářený KCl se rozpustí v peroxidu vodíku, tím dojde k oxidaci síry na síran (35SO42-), roztok se pak nechá projít katexem a následně anexem, čímž se zbavíme draselných iontů a chloridů. Následně se pomocí barnatých iontů vysráží síran barnatý, který se fosforem redukuje na oxid siřičitý, ten je pomocí PCl5 následně převeden na chlorid thionylu, 35SOCl2.
Chemické vlastnosti
Síra vytváří velké množství alotropických modifikací (v současnosti jich známe přes 30), nejběžnější modifikací je rombická α-S8, která je tvořena cyklickými osmiatomovými molekulami, je dobře rozpustná v CS2 a S2Cl2. Tuto modifikaci nacházíme v přírodě jako velké, žluté krystaly. Velice zajímavé je sledovat změny během zahřívání žluté, rombické modifikace síry. Při 95 °C přechází na monoklinickou β-S8, nad teplotou 119 °C pozorujeme tání síry. Pokud taveninu zahřátou nad 150 °C prudce ochladíme, např. vylitím do vody, získáme γ-S8. Pokud v zahřívání pokračujeme, pozorujeme vzrůst viskozity taveniny, až dojde k jejímu ztuhnutí, to je způsobeno otevíráním cyklů síry a jejich polymerací.
Sulfan a polysulfany
Sulfan, H2S, je plyn, toxičtější než HCN, ale díky charakteristickému zápachu, lze jeho přítomnost snadno detekovat. V přírodě vzniká při rozkladu látek obsahujících síru, může být obsažen např. zemním plynu, ze kterého se odstraňuje absorbcí do roztoku organických bází. Laboratorně ho lze vyrobit reakcí sulfidů s minerálními kyselinami, např:
FeS(s) + 2 HCl(aq) → H2S + FeCl2
Ve vodném roztoku se chová jako slabá kyselina (pKa1 = 7,04 a pKa2 = 19), teplota varu je −59 °C a tání −86 °C.
Polysulfany jsou sloučeniny s obecným vzorcem H2Sx, kde x>1. Lze je připravit rozpouštěním síry v roztoku alkalického sulfidu a následným okyselením roztoku. Získáme tak směs polysulfidů (x=2-6), kterou lze rozdělit frakční destilací, vyšší polysulfany lze připravit kondenzační reakcí:
2 H2S + SxCl2 → H2Sx+2 + 2 HCl
Oxidy síry
Síra tvoří poměrně velký počet oxidů, nejznámější a nejrozšířenější jsou oxid sírový (SO3) a siřičitý (SO2). S oxidem siřičitým se potkáváme denně v ovzduší s průmyslovým znečištěním, kromě toho vzniká i sopečnou činností. Oxid sírový je důležitý v průmyslu, při výrobě kyseliny sírové, kde se vyrábí oxidací SO2.
Kromě těchto dvou oxidů známe řadu nižších, se vzorcem SnO, které lze připravit reakcí cyklických modifikací síry s kyselinou trifluoroperoxooctovou za nízkých teplot, např. S2O a S8O. A také známe řadu vyšších oxidů, odvozených od oxidu sírového, např. SO4.
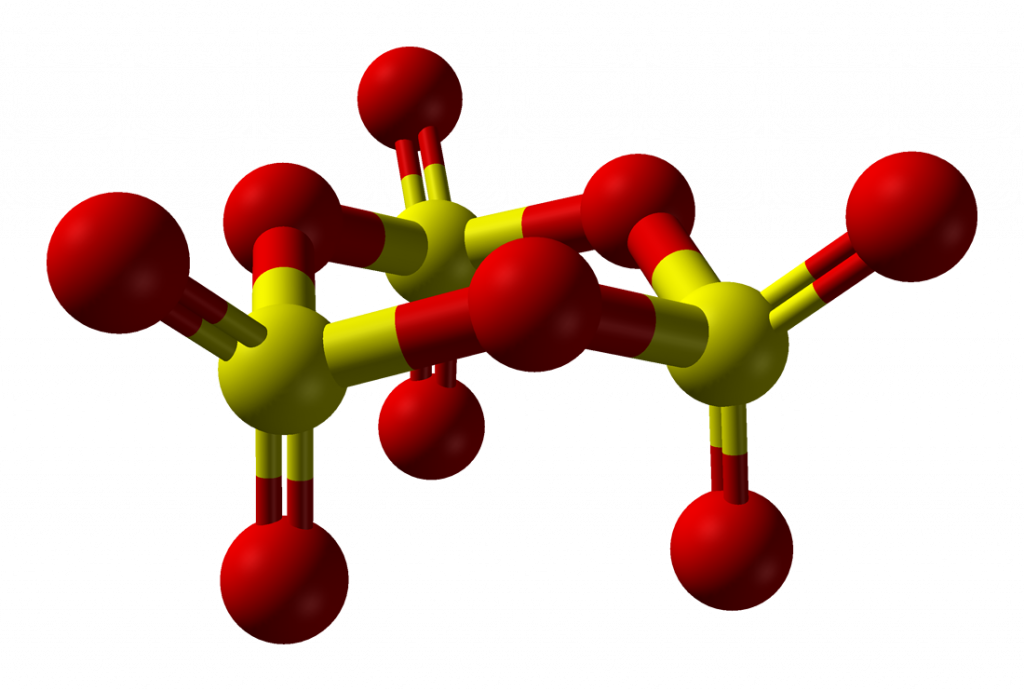
Oxid sírový
Oxid sírový, SO3, je bezbarvá olejovitá látka nebo bílá krystalická látka (v závislosti na modifikaci). V plynném stavu má monomerní formu, v souhlasu s teorií VSEPR má trojúhelníkovou geometrii (D3h). V kapalném a pevném stavu existuje rovnováha mezi monomerní a trimerní formou (S3O9).
Trimer má židličkovou konformaci.

Halogenid-oxidy síry
Známe dvě hlavní řady halogenid-oxidů síry: dihalogenidy thionylu se vzorcem SOX2 a dihalogenidy sulfurylu se vzorcem SO2X2. Molekuly SOX2 mají tvar pyramidy, grupa symetrie Cs. Chloridy a fluoridy jsou bezbarvé kapaliny, bromid thionylu je oranžový a méně těkavý. Jodid thionylu dosud nebyl připraven v čisté podobě, proto o něm není známo mnoho informací. Je to tmavě hnědá, pevná látka, která se za laboratorní teploty rozkládá.
V praxi je nejdůležitější chlorid thionylu (SOCl2), který se využívá k sušení a dehydrataci, protože velmi ochotně reaguje s vodou podle rovnice:
SOCl2 + H2O → SO2 + 2 HCl
Dále se používá v organické syntéze jako chlorační a oxidační činidlo a jako nevodné, aprotické rozpouštědlo.
Halogenidy sulfurylu jsou těkavé plyny a kapaliny a jsou hodně reaktivní. Fluorid sulfurylu se připravuje reakcí fluoru s oxidem siřičitým nebo fluorací chloridu sulfurylu. Ve směsi chloridu a bromidu sulfurylu dochází k ligandové výměně a vznikají směsné halogenidy sulfurylu.
Oxokyseliny síry
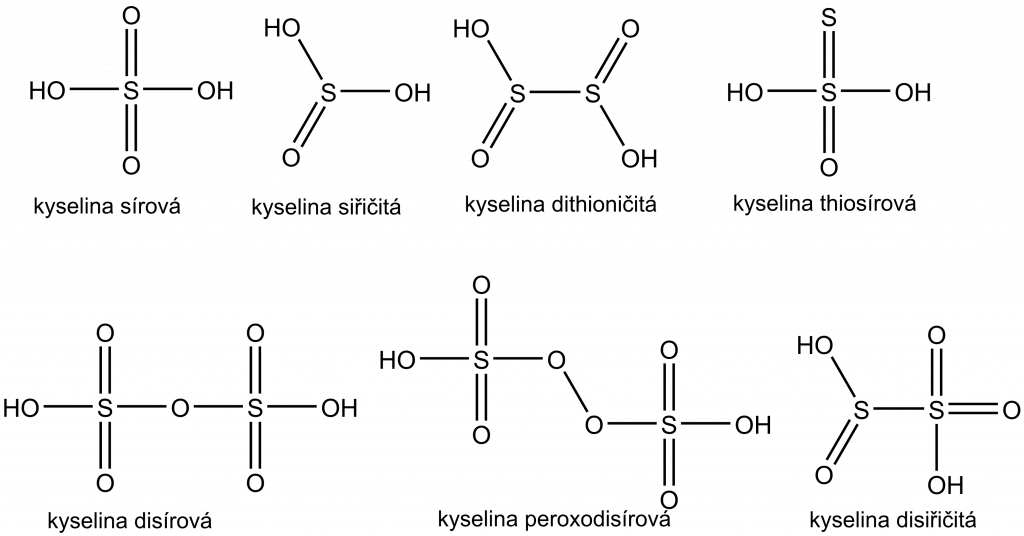
Síra vytváří poměrně širokou škálu oxokyselin, jejich chemie je podobná chemii kyselin fosforu. Nejdůležitější kyselinou je bezesporu kyselina sírová.
Přehled základních kyselin síry a hodnoty jejich pKa najdete v tabulce.
| Název | Vzorec | pKa |
|---|---|---|
| Kyselina sírová | H2SO4 | pKa2 = 1,92 |
| Kyselina siřičitá | H2SO3 | pKa1 = 1,82 pKa2 = 6,92 |
| Kyselina dithioničitá | H2S2O4 | pKa1 = 0,35 pKa2 = 2,45 |
| Kyselina disírová | H2S2O7 | pKa1 = 3,1 |
| Kyselina peroxodisírová | H2S2O8 | – |
| Kyselina thiosírová | H2S2O3 | pKa1 = 0,6 pKa2 = 1,74 |
Halogenidy síry
| S2F2 | F2S=S | SF4 | SF6 | S2F10 | |
|---|---|---|---|---|---|
| Vzhled | Bezbarvý plyn | Bezbarvý plyn | Bezbarvý plyn | Bezbarvý plyn, stabilní | Bezbarvá kapalina |
| Teplota tání [°C] | −133 | −165 | −125 | −51 (pod tlakem) | −53 |
| Teplota varu [°C] | 15 | −11 | −40 | −64 (sublimuje) | 30 |
| Délka vazby S-H [pm] | 163,5 | 160 | 164,5 (ax) 154,5 (eq) | 156 | 156 |
SF4 a S2F2 lze připravit reakcí SCl2 s HgF2 za zvýšené teploty. S2F2 existuje ve formě dvou izomerů, druhým je F2S=S. Struktura S2F2 je analogická O2F2, dihedrální úhel je 88°. Oba izomery jsou nestabilní a disproporcionují na SF4 a S.
SF4 je komerčně dostupný, využívá se jako selektivní fluorační činidlo, dokáže fluorovat karbonylové skupiny na CF2, aniž by došlo k reakci na jiných nenasycených místech molekuly. Vzhledem k jeho velké citlivosti na stopy vlhkosti je nutné s ním pracovat v inertní atmosféře. Nejsnáze se připravuje reakcí:
3 SCl2 + 4 NaF → SF4 + 4 NaCl + S2Cl2
S2F10 je tvořen dvěma tetragonálními pyramidami SF5 spojenými vazbou S-S. Je to silné oxidační činidlo, při zahřívání disproporcionuje na SF4 a SF6. S amoniakem reaguje za vzniku N≡SF3. Připravuje se reakcí SF5Cl s vodíkem.
SF6 je jediný stabilní fluorid síry, je i chemicky velmi inertní. Vyrábí se přímou fluorací síry, kdy vznikají i stopy S2F10.
S2Cl2 je toxická, zapáchající, oranžová kapalina. Vyrábí se probubláváním elementárního chloru taveninou síry. Lze jej dále chlorovat za vzniku SCl2. Oba tyto chloridy se využívají na přípravu thionylchloridu, S2Cl2 se používá při vulkanizaci gumy.
NMR
Síra se v NMR využívá velmi málo, protože jediný aktivní izotop je kvadrupól, má nízké zastoupení, nízkou citlivost a poskytuje široké signály. Standardem je (NH4)2SO4.
| 33S | |
|---|---|
| Spin | 3/2 |
| Zastoupení v přírodě [%] | 0,76 |
| Citlivost vzhledem k 1H | 0,00227 |
| Citlivost vzhledem k 13C | 0,101 |
| Rezonanční frekvence v poli 1 T | 3,2717 |
| Rozsah chemických posunů | 964 ppm, -290 až 674 |
Chemické posuny
| MoS42- | 700-650 |
| S6- | 400-200 |
| DMSO | 350-320 |
| Sírany, siřičitany | 50-(-50) |
| (NH4)2SO4 | 0 |
| S4- | -220-(-300) |
Odkazy – NMR
- Síra na české wikipedii
- Síra na anglické wikipedii
- 33S NMR
- Testing the sensitivity limits of 33S NMR: An ultra-wideline study of elemental sulfur
- Applicability of natural abundance 33S solid-state NMR to cement chemistry
- Native Sulphur – Mineral Properties, Photos and Occurrence
- HÁLA, Jiří. Radioaktivní izotopy. Tišnov: Sursum, 2013. ISBN 978-80-7323-248-1.
Navigace
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| H | He | ||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr |
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe |
| Cs | Ba | La | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| Fr | Ra | Ac | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |
| Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu |
| Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr |

4 Replies to “Síra”