Fosfor, P, je nekovový prvek, rozšířený v zemské kůře i v biologických organismech. Elementární fosfor vytváří několik alotropů. V zemské kůře je fosfor poměrně rozšířený, jak ve formě minerálů, tak i v živých organismech.
| Atomové číslo | 15 | Počet stabilních izotopů | 1 |
| Atomová hmotnost | 30,973 | Elektronová konfigurace | [Ne] 3s2 3p3 |
| Teplota tání [°C] | 44,15 | Teplota varu [°C] | 276,85 |
| Elektronegativita | 2,19 | Hustota [g.cm-3] | 1,823 (bílý) 2,34 (červený) 2,69 (černý) |
V přírodě se nachází pouze ve formě sloučenin, jde o 11. nejzastoupenější prvek, jeho koncentrace je 1-1,2 g/kg. Nejdůležitějšími minerály jsou apatity – fosforečnany vápníku – Ca5(PO4)3X (X = OH–, F–, Cl–, a další), dalším důležitým minerálem je fosforit Ca3(PO4)2. Reaktivita je silně závislá na jeho modifikaci, nejreaktivnější je bílý fosfor, který je na vzduchu pyroforický.
Elementární fosfor se vyrábí redukcí apatitu koksem v přítomnosti křemenného písku. Vyredukovaný fosfor z reaktoru těká a jímá se do vody jako bílý fosfor.
Izotopy
Přírodní fosfor je prakticky monoizotopický, skládá se z izotopu 31P a stopových množství izotopů 32P a 33P. Známe celkem 22 izotopů fosforu.
| Izotop | Zastoupení | Poločas rozpadu |
| 31P | 100 % | Stabilní |
| 32P | Stopové | 14,27 dnů |
| 33P | Stopové | 25,35 dnů |
Chemické vlastnosti
Hydridy fosforu
Nejstabilnějším hydridem je fosfan (PH3), jde o silně jedovatý, bezbarvý plyn s česnekovým zápachem. Ve větším množství jej lze připravit hydrolýzou fosfidu vápenatého:
Ca3P2 + 6 H2O → 2 PH3 + 3 Ca(OH)2
Velmi čistý se připravuje alkalickou hydrolýzou monojodfosforanu:
P4 + 2 I2 + 8 H2O → 2 PH4I + 2 HI + 2 H3PO4
PH4I + KOH → 2 PH3 + KI + H2O
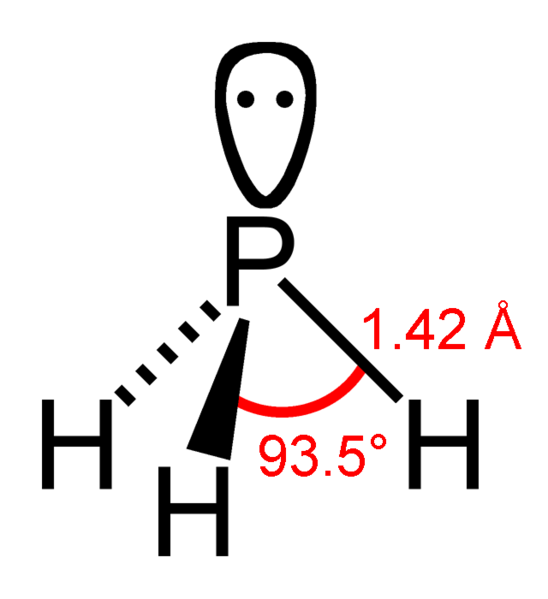
Fosfan je prvním členem homologické řady PnH2+n. Difosfan (P2H4) je bezbarvá kapalina, která se rozkládá při varu (63,5 °C), trifosfan (P3H5) je nestabilní plyn. Stabilita vyšších homologů rychle klesá.
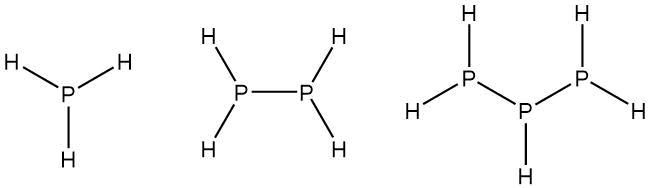
Fosfan byl detekován i v atmosféře Venuše.[10]
Fosforan (PH5) nebyl dosud izolován, ale jsou známy jeho deriváty. Ty získáme náhradou jednoho nebo více vodíků za jiný atom nebo skupinu, např. pentafenylfosforan (Ph5P). Fosforany mají geometrii trigonální bipyramidy.
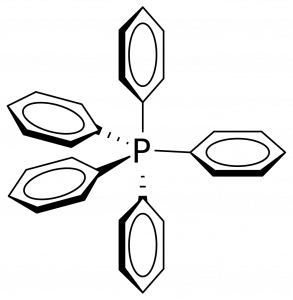
Fosforany typu R3P=CR2 jsou poměrně běžné a využívají se jako reaktanty ve Wittigově reakci, příkladem může být methylentrifenylfosforan (Ph3P=CH2).
Oxidy fosforu
Fosfor vytváří sérii oxidů P4O6 až P4O10. Všechny oxidy mají strukturu adamantanu, v oxidu fosforitém není žádný terminální oxid kyslíku, se zvyšujícím se průměrným oxidačním číslem fosforu postupně přibývají exocyklické kyslíky.
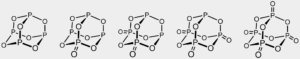
Oxid fosforitý lze připravit hořením fosforu v omezeném množství kyslíku, s vodou reaguje za vzniku kyseliny fosforité. Chová se jako Lewisova baze, protože každý fosfor má volný elektronový pár. Lze jej oxidovat kyslíkem až na P4O10, s ozonem reaguje za vzniku ozonidu P4O18.
Nejvýznamnějším oxidem fosforu je oxid fosforečný, P4O10.Využívá se také jako velmi dobré sušidlo a dehydratační činidlo. Dokáže převést primární amidy na nitrily.
Oxidy P4O7, P4O8 a P4O9 jsou tvořeny fosfory v oxidačním čísle III a V.
Kyseliny fosforu
Fosfor vytváří velké množství oxokyselin a příslušných solí nebo aniontů. Jejich strukturu lze obecně popsat pomocí několika jednoduchých pravidel:
- Všechny atomy fosforu v kyselině mají koordinační číslo 4 a obsahují minimálně jedno vazbu P-O.
- Všechny atomy fosforu vytvářejí minimálně jednu vazbu k ionizovatelné skupině OH.
- Pokud kyselina obsahuje jednu nebo více vazeb P-H, tyto vazby nelze ionizovat.
- U kyselin obsahujících více atomů fosforu, jsou tyto atomy propojeny buď kyslíkovým můstkem: P-O-P nebo přímou vazbou P-P.
- Peroxokyseliny obsahují skupinu P-O-O-H nebo P-O-O-P.
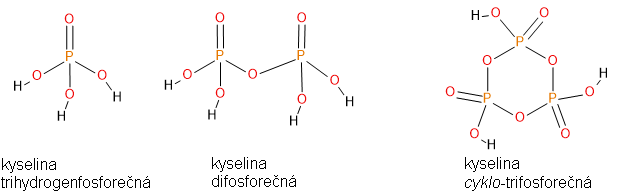
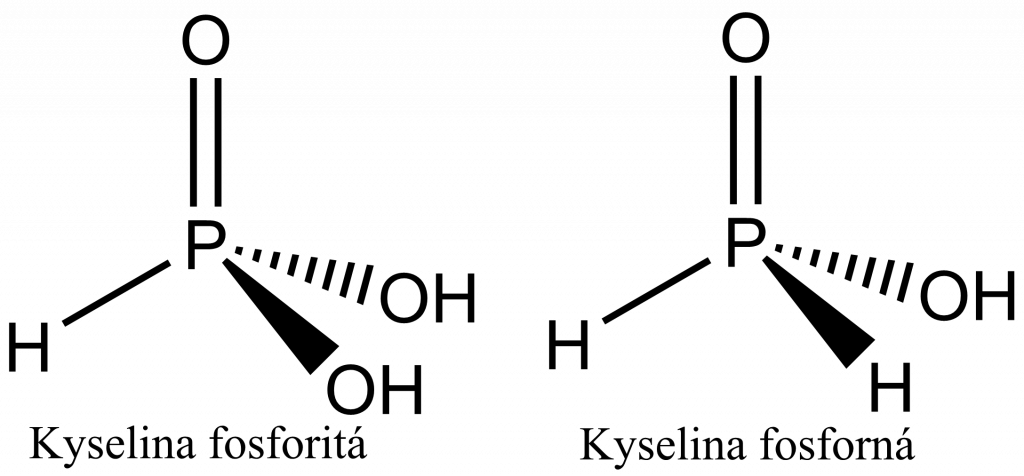
Kyselina fosforečná, přesněji trihydrogenfosforečná, je trojsytná kyselina tvořící tři řady solí (pKa1 = 2,16; pKa2 = 7,21; pKa3 = 12,67). Její estery s organickými alkoholy se nazývají fosfáty. Nahradíme-li jednu OH skupinu vodkem vázaným přímo na fosfor získáme kyselinou fosforitou, pokud místo vodíku bude na fosfor vázán organický zbytek, jedná se o fosfonát. Při náhradě dvou OH skupin vodíkem získáme kyselinu fosfornou, při náhradě organickým substituentem získáme fosfináty.
Kyselina fosforečná je velice důležitá surovina pro výrobu fosforečných hnojiv i pro potravinářský průmysl. Vyrábí se dvěma způsoby, pro potravinářství musí mít kyselina dostatečnou čistotu, proto se vyrábí spalováním fosforu ve směsi kyslíku a vodní páry v nerezovém reaktoru. Pro průmyslové účely se využívá levnější způsob, rozpouštění přírodního apatitu v kyselině sírové.
Ca5(PO4)3F + 5 H2SO4 + 10 H2O → H3PO4 + 5 CaSO4∙2H2O + HF
Kyselinu fosforitou (HPO(OH)2) lze připravit reakcí oxidu fosforitého s vodou za studena. Při zvýšení teploty dochází k disproporcionační reakci a vzniká fosfan a kyselina fosforečná. Z tohoto důvodu se využívá hydrolýza chloridu nebo bromidu fosforitého.
PCl3 + 3 H2O → H3PO3 + 3 HCl
Kyselina fosforná (H2PO(OH)) se v syntéze využívá jako silné redukční činidlo. Připravuje se reakcí horkého roztoku bílého fosforu s hydroxidem a následnou neutralizací vzniklé soli.
Halogenidy fosforu
Fosfor vytváří tři řady halogenidů od nichž známe všechny zástupce – PX5, PX3 a P2X4 (tetrahalogendifosfany). Jedinou výjimkou je P2Br4, o kterém lze najít pouze pár údajů, např. v odkazu 8.
| Látka | Skupenství/vzhled při 25 °C | Tt [°C] | Tv [°C] |
|---|---|---|---|
| P2F4 | bezbarvý plyn | −86,5 | −6,2 |
| P2Cl4 | bezbarvá kapalina | −28 | 180 (rozklad) |
| P2Br4 | ? | – | – |
| P2I4 | červená pevná látka | 125,5 | rozklad |
| PF3 | bezbarvý plyn | −151,5 | −101,8 |
| PCl3 | bezbarvá kapalina | −93,6 | 76,1 |
| PBr3 | bezbarvá kapalina | −41,5 | −173,2 |
| PI3 | červené krystaly | 61,2 | nad 200 se rozkládá |
| PF5 | bezbarvý plyn | −93,7 | −84,5 |
| PCl5 | bílé krystaly | 167 | 160 (sublimuje) |
| PBr5 | načervenale žluté krystaly | 100 (rozklad) | – |
| PI5 | hnědočerné krystaly | 41 | – |
Chlorid fosforečný
Krystalický chlorid fosforečný má iontový charakter a lze ho popsat vzorcem [PCl4][PCl6]. Vyrábí se reakcí roztoku chloru s roztokem PCl3 (v CCl4), laboratorně ho lze připravit přímým zaváděním chloru do PCl3.
S vodou reaguje buď za vzniku H3PO4 (v nadbytku vody), nebo POCl3 (při reakci v poměru 1:1).
Sulfidy fosforu
Sulfidy fosforu se svou strukturou od oxidů odlišují, nacházíme u nich přímou vazbu P-P, sulfid fosforitý, P4S6, obsahuje jednu vazbu P-P a jednu exocyklickou vazbu P-S.
Reakcí fosforu se sírou při teplotách nad 300 °C vzniká P4S10. Jeho hydrolýzou vzniká kyselina fosforečná a sulfan.
P4S10 + 16 H2O → H3PO4 + H2S
Sulfid P4S3 vzniká reakcí síry s červeným fosforem při teplotách nad 250 °C, tento sulfid se používá v hlavičkách sirek.
31P NMR
V NMR je 31P důležité jádro, protože má 100 % zastoupení a relativně vysokou citlivost. Je přítomen v nukleových kyselinách, což umožňuje studium jejich struktury pomocí vícedimenzionální NMR (např. 31P-31P COSY).
| 31P | |
|---|---|
| Spin | 1/2 |
| Zastoupení v přírodě [%] | 100 |
| Rozsah chemických posunů | 300 – (-300) ppm |
| Citlivost vzhledem k 1H | 0,06652 |
| Citlivost vzhledem k 13C | 37,7 |
| Rezonanční frekvence v poli 1 T | 17,2515 |
Chemické posuny
| Skupina látek | Chemický posun [ppm] | Skupina látek | Chemický posun [ppm] |
| RPCl2 | 204-166 | R3PS | 57-31 |
| RP(OR’)2 | 188-151 | (RO)3PO | 4-(-16) |
| (RO)3P | 140-125 | (RO)2PHO | 11-(-1) |
| R2PCl | 133-83 | R4P+ | 56-19 |
| R2POOR‘ | 64-15 | R3PO | 56-31 |
| R3P | 61-(-62) | R2PH | 20-(-100) |
| RPO(OR‘)2 | 37-15 | RPH2 | -82-(-164) |
Odkazy
- Fosfor na české wikipedii
- Fosfor na anglické wikipedii
- Synthesis and Phase Relations of Single-Phase Fibrous Phosphorus
- Some Common 31P Chemical Shifts
- P2O4 poprvé připraven
- The NMR spin–spin coupling constant 1J(31P,1H) in an isolated PH3 molecule
- 1D 1H-31P HOESY
- NMR evidence for new phosphorus halides
- Phosphorus chlorides — A hugely useful group of compounds that have a distinct dual personality
- Fosfan na Venuši. Je v pekle život?
Navigace
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| H | He | ||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr |
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe |
| Cs | Ba | La | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| Fr | Ra | Ac | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |
| Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu |
| Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr |
One Reply to “Fosfor”