VSEPR, Valence Shell Electron Pair Repulsion, je teorie, která předpovídá rozložení vazebných elektronových párů v prostoru a tím i tvar molekuly. Tato teorie je použitelná pouze pro sloučeniny nepřechodných prvků.
Teorie byla poprvé formulována v roce 1939 Ryutarem Tsuchidou, v roce 1957 pak byla rozšířena a upravena Ronaldem Gillespie a Ronaldem Sydney Neyholmem, aby byla schopná poskytnout výběr několika alternativních geometrií.
Platí tři základní pravidla:
- Elektronové páry centrálního atomu se v prostoru rozmístí tak, aby byly co nejdále od sebe a měly minimální energii.
- Nevazebný elektronový pár odpuzuje ostatní elektronové páry nejvíce, odpuzování vazebných elektronových párů je slabší a klesá v pořadí trojná vazba > dvojná vazba > jednoduchá vazba. Vazba k elektropozitivnějšímu atomu vykazuje větší odpuzování než vazba k atomu s vyšší elektronegativitou.
- Tvar molekuly je dán pouze polohou vazebných elektronových párů.
Konkrétní ukázky aplikace jsou v tomto článku.
Notace AXE
Pro potřeby VSEPRu používáme k označování molekul notaci AXE, symbolem A označujeme centrální atom, X jsou ligandy a E nevazebné elektronové páry. Např. CO2 označíme jako AX2 a SO2 jako AX2E. Takto můžeme snadněji určit výchozí tvar a následně konečný tvar molekuly.
Výchozí tvary
Při určování tvaru molekuly nejprve spočítáme počet vazebných (σ) i nevazebných elektronových párů, celkový počet párů nám určí výchozí tvar.
| Počet párů | Hybridizace | Tvar | |
|---|---|---|---|
| 2 | sp | lineární | |
| 3 | sp2 | trojúhelník | 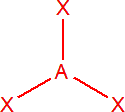 |
| 4 | sp3 | tetraedr | 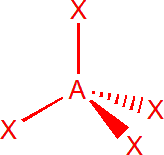 |
| 5 | sp3d | trigonální bipyramida | 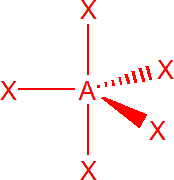 |
| 6 | sp3d2 | oktaedr | 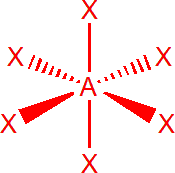 |
| 7 | sp3d3 | pentagonální bipyramida | 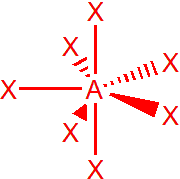 |
Určení tvaru molekuly
Pokud nejsou na centrálním atomu žádné volné páry, odpovídá tvar molekuly příslušnému výchozímu tvaru, v případě že nejsou všechny ligandy shodné, dochází k deformaci úhlů, tak aby odpuzování elektronových párů bylo minimální. V případě vazeb stejného řádu, rozhoduje o míře odpuzování elektronegativita atomu, který je navázán na centrální atom. Síla repulze (odpuzování) klesá v pořadí:
nevazebný elektronový pár > trojná vazba > dvojná vazba > jednoduchá vazba
Čím bude elektronová hustota v blízkosti centrálního atomu vyšší (tzn. čím bude elektronegativita navázaného atomu nižší), tím bude odpuzování silnější.
Dva elektronové páry
Molekuly typu AX2 (např. CO2) i AXE (např. CO) jsou vždy lineární, vazebný úhel je 180°.
Tři elektronové páry
Výchozím tvarem je rovnostranný trojúhelník, např. pro BCl3, vazebné úhly jsou 120°. Pokud je jeden elektronový pár nevazebný, je tvar molekuly lomený s vazebným úhlem menším než 120°, např. u SO2.
Čtyři elektronové páry
Výchozím tvarem je tetraedr, kde jsou vazebné úhly 109,5°, příkladem může být molekula methanu (CH4). Pokud je jeden pár nevazebný, získáme trojbokou pyramidu (NH3), úhly jsou menší než 109,5°. Pokud jsou dva páry nevazebné, je tvar molekuly lomený (H2O) s úhlem menším než 109,5°.
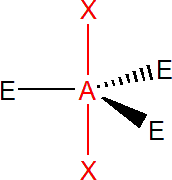
Pět elektronových párů
Výchozím tvarem je trojboká bipyramida, vazebné úhly jsou v equatoriální rovině (trojúhelníková podstava) 120° a mezi axiální a equatoriální rovinou 90°, z toho důvodu volné elektronové páry obsazují equatoriální rovinu. takže PCl5 má tvar trojboké bipyramidy. SF4 má tvar, který se označuje jako houpačka, úhly jsou 90° a 120°.
Pokud jsou dva elektronové páry nevazebné, získáme tvar T, s úhlem 90°, jde např. o ClF3. V případě tří nevazebných elektronových párů získáme lineární tvar, jde např. o XeF2.

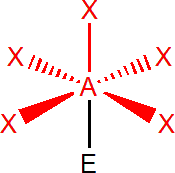
Šest elektronových párů
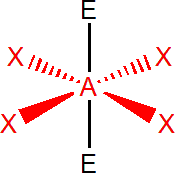
Výchozím tvarem je oktaedr, se všemi úhly 90°, např. SF6. V případě, že je jeden elektronový pátr nevazebný, např. u BrF5, získáme čtyřbokou pyramidu, s úhly menšími než 90°. Dva nevazebné elektronové páry, např. u XeF4, obsadí protilehlé pozice, tzn. že molekula má tvar čtverce.

Sedm elektronových párů
Výchozím tvarem je pentagonální bipyramida, vazebné úhly v ekvatoriální rovině jsou 72°, a mezi axiálními a ekvatoriálními ligandy 90°. Příkladem je interhalogenid IF7. V případě, že je jeden elektronový pátr nevazebný, např. u XeOF5–, získáme pentagonální pyramidu. Dva nevazebné elektronové páry, např. u aniontu XeF5–, obsadí protilehlé pozice, tzn. že molekula bude planární, tvar pětiúhelníku.

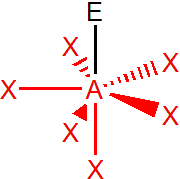
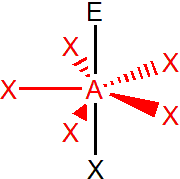
Vliv elektronegativity
Elektronegativita atomů ovlivňuje rozložení elektronové hustoty podél chemické vazby. Snižování elektronové hustoty v blízkosti centrálního atomu způsobuje zmenšování repulze a tím i zmenšování vazebných úhlů. Můžeme si to demonstrovat na halogenidech fosforitých.
| Halogenid | PF3 | PCl3 | PBr3 |
| Elektronegativita halogenu | 3,98 | 3,16 | 2,96 |
| Rozdíl elektronegativit (P-X) | 1,79 | 0,97 | 0,77 |
| Vazebný úhel XPX | 97,8° | 100,3° | 101,0° |
Nejelektronegativnějším halogenem je samozřejmě fluor, ve fluoridu fosforitém je tedy elektronová hustota silně přesunuta k fluoridům, z toho důvodu je odpuzování vazebných elektronových párů menší a tím dochází k největší deformaci vazebného úhlu (deformaci způsobuje nevazebný elektronový pár na fosforu).
Se snižující se elektronegativitou halogenu se zvyšuje elektronová hustota v blízkosti centrálního atomu, což způsobuje zvyšování repulze a zvětšování vazebného úhlu.
Podobnou závislost pozorujeme i halogenidů arsenitých, hodnoty vazebných úhlů jsou zde ovlivněny i velikostí centrálního atomu:
| Halogenid | AsF3 | AsCl3 | AsBr3 |
| Elektronegativita halogenu | 3,98 | 3,16 | 2,96 |
| Rozdíl elektronegativit (P-X) | 1,80 | 0,98 | 0,78 |
| Vazebný úhel XPX | 95,8° | 98,9° | 99,8° |
Vliv velikosti atomů
S rostoucím poloměrem centrálního atomu dochází ke snižování velikosti vazebného úhlu, to je způsobeno prodlužováním vazby mezi centrálním atomem a ligandy.
| Molekula | H2S | H2Se | H2Te |
| Vazebný úhel [°] | 92,1 | 91 | 90 |
Se zvětšováním velikosti ligandu dochází ke zvětšování vazebného úhlu, to je způsobeno sterickými (prostorovými) faktory.
Odkazy
- VSEPR na anglické Wikipedii
- Molecular geometry and lone pairs
- Valence Shell Electron Pair Repulsion Theory
- VSEPR-Plus: Correct Molecular and Electronic Structures Can Lead to Better Student Conceptual Models
Další kapitoly
- České chemické názvosloví
- Platné číslice a měření
- Základní chemické zákony
- Důležité veličiny a vztahy v chemii
- Výpočet stechiometrického vzorce
- Chemické rovnice a stechiometrické výpočty
- Koncentrace roztoků
- Rozpustnost, součin rozpustnosti
- Stavba atomu
- Periodická tabulka prvků a periodicita vlastností
- Chemická vazba
- VSEPR
- Komplexní sloučeniny
- Magnetické vlastnosti látek
- Termodynamika
- Chemická rovnováha
- Skupenské stavy látek
- Fázové rovnováhy
- Teorie kyselin a zásad
- pH, aktivita roztoku
- Elektrochemie
- Symetrie molekul
- Laboratorní technika
- Lineární regrese
- Jednotky tlaku
- Jednotky teploty
- Mohsova stupnice tvrdosti minerálů
- Odkazy
- Prezentace k semináři z obecné chemie







