Vanad najdeme v periodické tabulce v 5. skupině, společně s niobem, tantalem a dubniem. Využívá se hlavně pro přípravu slitin a katalyzátorů.
| Atomové číslo | 23 | Elektronová konfigurace | [Ar]3d3 4s2 |
|---|---|---|---|
| Počet přírodních izotopů | 2 (50V, 51V) | Atomová hmotnost | 50,9415 |
| Elektronegativita | 1,6 | Hustota | 6,11 g.cm-3 |
| Teplota tání | 1915 °C | Teplota varu | 3350 °C |

Výskyt a výroba
Vanad je v přírodě poměrně hojným prvkem, obsah v zemské kůře je 136 ppm, ale většinou se vyskytuje jen v malých množstvích. Asi nejdůležitějším nerostem vanadu je patronit VS4, černý, měkký polysulfid. Vanad se vyrábí pražením rozemleté rudy s NaCl nebo Na2CO3 při teplotě 850 °C. Vzniklý vanadičnan se vyluhuje vodou a po okyselení na pH 2-3 se získá polyvanadičnan, který je následně přetaven na oxid vanadičný. Ten se pak dále redukuje, nejčastěji železem, surový vanad (ferovanad) se pak přímo používá na legování ocelí.
Izotopy vanadu
Přírodní vanad je tvořen stabilním izotopem 50V (99,75 %) a malým podílem izotopu 51V s velmi dlouhým poločasem rozpadu (1,5.1017 let).
| Izotop | Zastoupení na Zemi | Poločas rozpadu |
| 50V | 0,25 % | 1,5.1017 let |
| 51V | 99,75 % | Stabilní |
48V
Z nestabilních izotopů má praktické aplikace 48V, který se využívá ke studiu chování vanadu v životním prostředí a v toxikologii. Připravuje se ozařováním přírodního titanu v cyklotronu:
$$^{48}_{22}\textrm{Ti}\ +\ ^1_1\textrm{p}\ \rightarrow\ ^{48}_{23}\textrm{V}\ +\ ^{1}_{0}\textrm{n}$$
Izotop se získává rozpuštěním terče v koncentrované kyselině sírové, odpařením roztoku a žíháním odparku. Oxid titaničitý se pak separuje žíháním se směsí uhličitanu a dusičnanu sodného. Loužením taveniny se pak získá roztok vanadičnanu, titan ve formě hydroxidu je nerozpustný a zůstává v pevné fázi.
Jeho poločas rozpadu je 15,97 dne:
$$^{48}_{23}\textrm{V}\ \rightarrow\ ^{48}_{22}\textrm{Ti}\ +\ \beta^+$$
Chemické vlastnosti
Vanad ve sloučeninách dosahuje oxidačních čísel od -III do +V. Nejstálejší jsou sloučeniny VIV.
| Oxidační číslo | Příklad sloučeniny | Oxidační číslo | Příklad sloučeniny |
|---|---|---|---|
| -III | [V(CO)5]3- | II | [V(CN)6]4- |
| -I | [V(CO)6]– | III | [VCl4]– |
| 0 | [V(CO)6] | IV | VCl4 |
| I | [V(bipy)3]+ | V | VOCl3 |
Oxidy vanadu
Vanad vytváří čtyři základní oxidy (V2O5, VO2, V2O3 a VO) a řadu nestechiometrických.
Oxid vanadičný
V2O5 vzniká zahříváním vanadu v kyslíkové atmosféře, nebo lépe termickým rozkladem metavanadičnanu amonného. Druhým způsobem získáme čistý oxid.
2 NH4VO3 → V2O5 + 2 NH3 + H2O
V čistém stavu je žlutooranžový. Zahříváním vratně uvolňuje kyslík, čímž se stává velmi žádaným katalyzátorem, nahradil např. platinu při oxidaci SO2 na SO3 při výrobě kyseliny sírové.
V2O5 + SO2 → 2 VO2 + SO3
4 VO2 + O2 → 2 V2O5

Je amfoterní, ochotně se rozpouští v kyselinách za vzniku dioxovanadičného kationtu (VO2)+, v roztocích alkalických hydroxidů tvoří orthovanadičnanové ionty VO43-.
Oxid vanadičitý
VO2 je také amfoterní, v neoxidujících kyselinách poskytuje modře zabarvené roztoky vanadylu (VO)2+, v alkalických roztocích tvoří ionty (V4O9)2-, a při vysokém pH (VO4)4-.

Mezi V2O5 a VO2 existuje celá řada oxidů s obecným vzorcem VnO2n+1. Další redukcí VO2 (pomocí H2, C nebo CO) získáme oxidy se vzorcem VnO2n-1. Nakonec získáme černý oxid vanaditý.
Termochromismus
Oxid vanadičitý je studován jako potenciální spektrálně selektivní povrch oken, který dokáže snižovat propustnost okna pro infračervené záření a tím snižovat tepelné ztráty v budovách.[6]
Vykazuje také termochromismus, tzn. změnu barvy s teplotou. Při nižších teplotách než 68 °C je průhledný a polovodivý, při vyšší teplotě se stává neprůhledným vodičem.[7] Přechod mezi těmito dvěma stavy proběhne za dobu kratší než 100 fs, což je použitelné pro konstrukci extrémně rychlé závěrky.
Také lze tento oxid použít pro konstrukci materiálů (např. pro střechy), které v závislosti na teplotě okolí budou teplo odrážet a tím ochlazovat budovy. Za nižších teplot, kdy je ochlazování nežádoucí, bude tato funkce potlačena.[8, 9]
Oxid vanaditý
V2O3 má strukturu korundu. Za laboratorní teploty jde o vodič, při ochlazení pod −103 °C se stává izolantem. Je to zásadotvorný oxid.
Sulfidy, selenidy a telluridy
Těžších chalkogenidů známe poměrně velké množství (viz tabulka dole), jejich struktury jsou odlišné od oxidů. Sulfid VS má strukturu typu NiAs.
| Sulfidy | Selenidy | Telluridy |
| V3S | V2Se | |
| V5S4 | V5Se4 | V5Te4 |
| VS | VSe | VTe1+x |
| V7S8 | V7Se8 | |
| V3S4 | V3Se4 | V3Te4 |
| V2S3 | V2Se3 | V2Te3 |
| V5S8 | V5Se8 | V5Te8 |
| VS4 | VSe2 | VTe2 |
Halogenidy vanadu
Je známo dvanáct halogenidů vanadu. VF5 lze snadno připravit reakcí fluoru s vanadem za zvýšené teploty. Je těkavý a snadno hydrolyzuje, vanad má koordinační číslo 6, jeho struktura je tvořena řetězci oktaedrů VF6 propojených přes vrchol.
VF4 lze připravit akcí HF s VCl3, snadno disproporcionuje na VF5 a VF3.
VF3 lze připravit reakcí HF s VCl3 za horka. Připravuje se dvoukrokovou syntézou z oxidu vanaditého a hydrogendifluoridu amonného:
V2O3 + 6 (NH4)HF2 → 2 (NH4)3VF6 + 3 H2O
(NH4)3VF6 → 3 NH3 + 3 HF + VF3
VF2 má silné redukční účinky a je hygroskopický.
| Sloučenina | Barva | Tt [°C] | Tv [°C] |
| VF2 | modrý | ||
| VF3 | žlutozelený | 800 | |
| VF4 | citronově zelený | >150 (sublimace) | |
| VF5 | bezbarvý | 19,5 | 48,3 |
| VCl2 | světle zelený | 910 (sublimace) | |
| VCl3 | červenofialový | ||
| VCl4 | červenohnědý | -26 | 148 |
| VBr2 | hnědooranžový | 800 (sublimace) | |
| VBr3 | šedohnědý | ||
| VBr4 | červenofialový | -23 (rozklad) | |
| VI2 | červenofialový | ||
| VI3 | hnědočerný |
Využití
Hlavní využití nachází vanad v ocelářském průmyslu, nejčastěji ve formě ferrovanadu. Dále se s vanadem setkáváme v oblasti katalýzy a ionty vanadu jsou součástí redoxních průtočných baterií.
Ferrovanad
Ferrovanad je slitinou vanadu s železem, vyrábí se nejčastěji redukcí oxidu vanadičného ferrosiliciem (FeSi):
2 V2O5 + 5 Si + 10 CaO → 4 V + 5 Ca2SiO4
Vx + Fe1-x → (Fe1-xVx)
Obsah vanadu se pohybuje mezi 35 až 80 %. Nejběžnější je FeV80, ten obsahuje 80 % vanadu.
Vanad v ocelích vytváří jemná zrna karbidu V4C3, který zvyšují odolnost vůči opotřebení, a to i za vysokých teplot. Využívají se např. při konstrukci pružin a rychlořezných ocelí.
Katalýza
Vanad se využívá při výrobě kyseliny sírové, V2O5 katalyzuje oxidaci oxidu siřičitého na oxid sírový:[11,12]
V2O5 + SO2 →2 VO2 + SO3
4 VO2 + O2 → 2 V2O5
K oxidaci n-butanu na maleinanhydrid se používá tzv. VPO katalyzátor.[13] Ten se připravuje reakcí V2O5 s H3PO4.
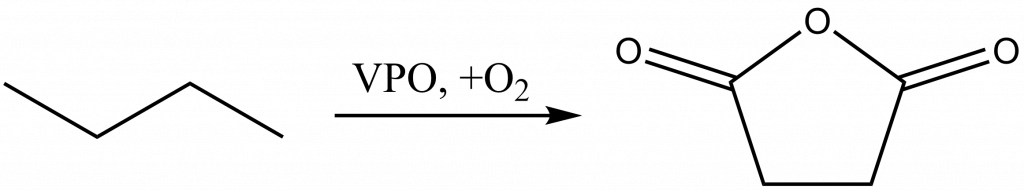
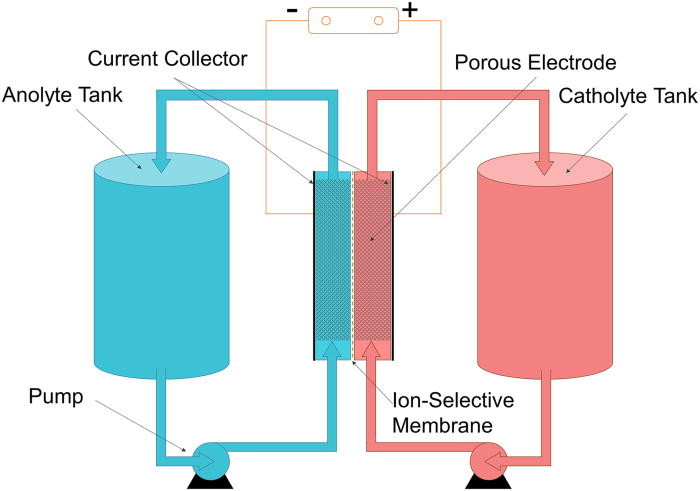
Vanadové průtočné baterie
Vanadové redoxní baterie jsou typem průtočných baterií, mohou být velmi významnou technologií pro zálohování obnovitelných zdrojů elektrické energie.[14] Výhodou těchto baterií je snadná škálovatelnost, ve srovnání se statickými články. Kapacita baterie je dána objemem elektrolytu a její výkon je dán povrchem elektrod a počtem článků. Elektrolyt v kladném poločlánku je tvořen ionty VO2+ a VO2+ a v záporné pak V2+ a V3+. Lze jej připravit elektrolytickým rozpouštěním V2O5 v kyselině sírové.
V roce 2022 Čína zprovoznila v Ta-lienu největší baterii tohoto typu, jako úložiště pro elektřinu získávanou z obnovitelných zdrojů (slunce a větru). Baterie dokáže uložit 400 MWh energie a do sítě zvládne dodávat
100 MW. Do budoucna je plánováno zvýšit tyto parametry na dvojnásobek.[15,16]
Vanadiové NMR
Vanad má dva přírodní a NMR aktivní izotopy – 50V a 51V. Izotop 50 je velmi málo citlivý, poskytuje velmi široké linie a je slabě radioaktivní, proto se nejčastěji využívá izotop 51. Jako standard se používá 90 % roztok VOCl3 v C6D6, jeho posun je 2 ppm.
| 50V | 51V | |
|---|---|---|
| Spin | 6 | 7/2 |
| Zastoupení v přírodě [%] | 0,25 | 99,75 |
| Rozsah chemických posunů | -2000 – 4000 | |
| Citlivost vzhledem k 1H | 1,39×10-4 | 0,383 |
| Citlivost vzhledem k 13C | 0,818 | 2250 |
| Rezonanční frekvence v poli 1 T | 4,2505 | 11,2133 |
Vzhledem k téměř 100 % zastoupení izotopu 51V a faktu, že vanad vytváří velké množství polyiontů a klastrů se často měří i 51V-51V COSY NMR.
Odkazy
- Vanad na české wikipedii
- Vanad na anglické wikipedii
- Vanadium NMR
- 51V NMR Crystallography of Vanadium Chloroperoxidase and Its Directed Evolution P395D/L241V/T343A Mutant: Protonation Environments of the Active Site
- HÁLA, Jiří. Radioaktivní izotopy. Tišnov: Sursum, 2013, s. 93. ISBN 978-80-7323-248-1.
- Intelligent Window Coatings that Allow Light In but Keep Heat Out – News Item
- Timing nature’s fastest optical shutter
- Smart roof coating reflects heat in summer and traps it in winter
- Důmyslný střešní materiál se ochlazuje v létě a ohřívá v zimě
- Muchomůrka červená a vanad
- Catalytic Applications of Vanadium: A Mechanistic Perspective
- Deactivation and Compound Formation in Sulfuric-Acid Catalysts and Model Systems
- Evolution of a VPO Catalyst in n-Butane Oxidation Reaction During the Activation Time
- Kam s elektřinou? Řešením mohou být vanadové průtočné baterie
- Čína spustila největší redox flox baterii na světě se 100MW/400MWh
- China connects world’s largest redox flow battery system to grid
Navigace
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| H | He | ||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr |
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe |
| Cs | Ba | La | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| Fr | Ra | Ac | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |
| Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu |
| Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr |
2 Replies to “Vanad”