Nikl patří mezi přechodné kovy, je součástí mnoha důležitých slitin. Využívá se také jako povrchová (antikorozní) úprava kovových předmětů. V přírodě se vyskytuje pět stabilních izotopů. Pro NMR je využitelný 61Ni.
| Atomové číslo | 28 | Počet stabilních izotopů | 5 |
| Atomová hmotnost | 58,6934 | Elektronová konfigurace | [Ar] 3d8 4s2 |
| Teplota tání [°C] | 1455 | Teplota varu [°C] | 3003 |
| Elektronegativita | 1,91 | Hustota [g.cm-3] | 8,908 |

Jako prvek byl nikl objeven a popsán až v 18. století, ale jeho slitiny byly používány už ve staré Číně. V přírodě je zastoupen hojně, v ryzím stavu pouze ve slitině s železem v meteoritech. Má vysokou afinitu ke kyslíku, síře a arsenu, jejichž sloučeniny tvoří hlavní zdroje niklu.
Izotopy
Přírodní nikl se skládá z šesti izotopů, pět z nich je stabilních. Dále známe 26 radioizotopů.
| Izotop | Zastoupení [%] | Poločas přeměny |
| 58Ni | 68,1 | stabilní |
| 59Ni | stopové | 7,6 ×104 let |
| 60Ni | 26,2 | stabilní |
| 61Ni | 1,14 | stabilní |
| 62Ni | 3,63 | stabilní |
| 64Ni | 0,926 | stabilní |
63Ni
Izotop 63Ni má poločas přeměny 100,1 let, mechanismem β– vzniká 63Cu:[14]
$$^{63}\textrm{Ni }\rightarrow\ ^{63}\textrm{Cu}\ +\ \beta^-$$
Připravuje se ostřelováním niklové fólie neutrony v jaderném reaktoru:
$$^{62}\textrm{Ni }+\ \textrm{n}\ \rightarrow\ ^{63}\textrm{Ni}\ +\ \gamma$$
Využívá se jako zdroj β– záření pro detekci plynů, např. v detektorech chlóru nebo jako součást detektoru u plynové chromatografie (GC).
Výskyt
Hlavními minerály niklu jsou nikelin (NiAs), pentlandit ((Fe,Ni)9S8) a millerit (NiS).[9-12]
Výroba niklu
Surový nikl se získává pražením a redukcí sulfidických rud. Sulfid se oxiduje na oxid, který lze využít v ocelářství, příp. se následně redukuje koksem na kovový nikl.
Rafinace surového niklu se provádí elektrolyticky, surový nikl slouží jako anoda, katodou je čistý nikl a elektrolytem vodný roztok síranu nebo chloridu nikelnatého. Během elektrolýzy se rozpouští nikl z anody a vylučuje se na katodě, získaný kov má čistotu vyšší než 99,9 %.
Druhou metodu výroby čistého niklu vyvinul L. Mond v roce 1889.[8] Oxid se redukuje vodním plynem (směs H2O a CO), čímž dojde ke vzniku těkavého Ni(CO)4 (tetrakarbonyl niklu), ten se rozloží za vyšší teploty (220–250 °C) na nikl a oxid uhelnatý. Čistota takto připraveného niklu je 99,95 %.
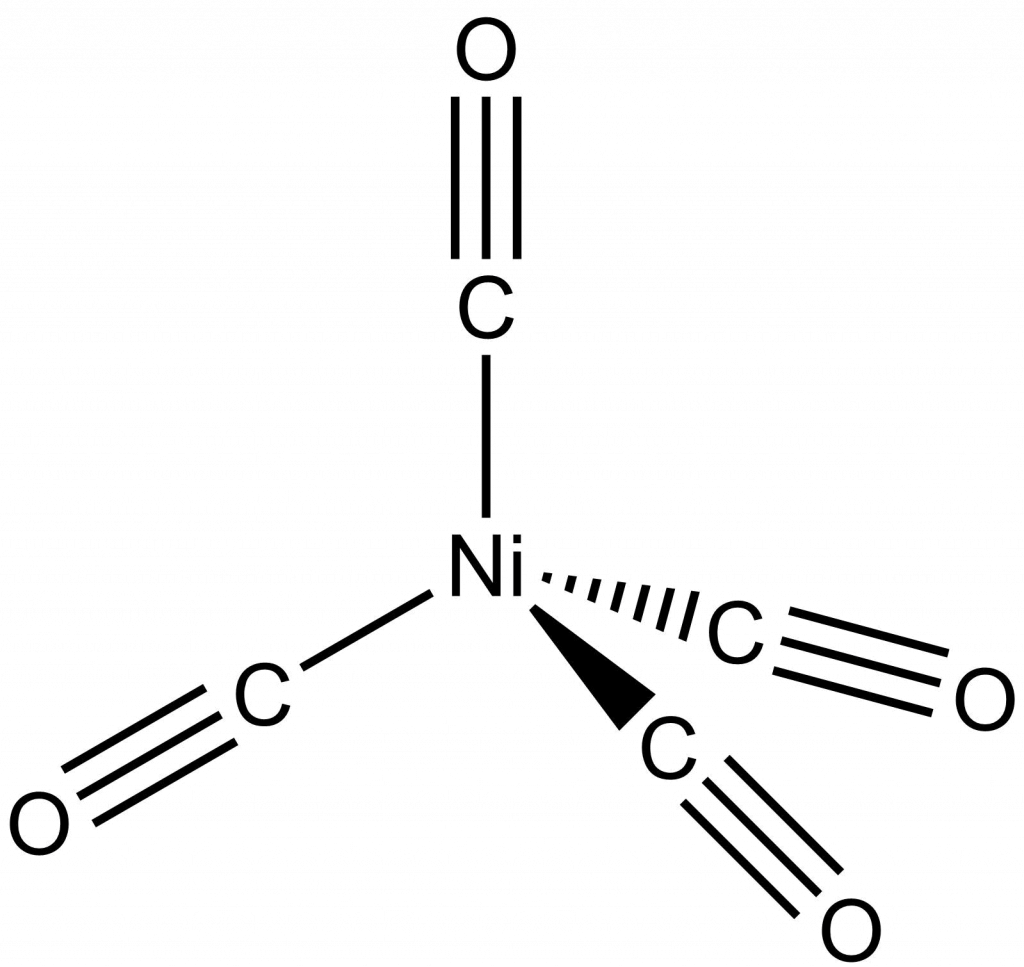
Využití niklu
Většina niklu se využívá pro přípravu nerezové oceli a dalších slitin.
V chemickém průmyslu a výzkumu je důležitou slitinou Monelův kov, což je slitina niklu (52-67 %), mědi a malého množství manganu a železa. Využívá se pro práci v agresivním prostředí, např. s plynným fluorem. Poprvé byl Monel vyroben roku 1901.

Raneyův nikl
Šedý prášek, složený převážně z niklu, vyrábí se ze slitiny niklu s hliníkem. Ta je rozpuštěna v hydroxidu sodném, hliník reaguje s hydroxidem za vývoje vodíku, který se nasorbuje na povrch zrn niklu (ten s hydroxidem sodným nereaguje).
2 Al + 2 NaOH + 6 H2O → 2 Na[Al(OH)4] + 3 H2

Díky obsahu vodíku je Raneyův nikl pyroforický a musí se uchovávat tak, aby se zabránilo kontaktu se vzdušným kyslíkem. Využívá se jako hydrogenační katalyzátor v organické syntéze. Poprvé byl použit v roce 1926 americkým inženýrem Murrayem Raneyem k hydrogenaci rostlinného oleje.[13]
V současnosti se používá ve velkém množství průmyslových aplikací, např. při redukci benzenu na cyklohexan.
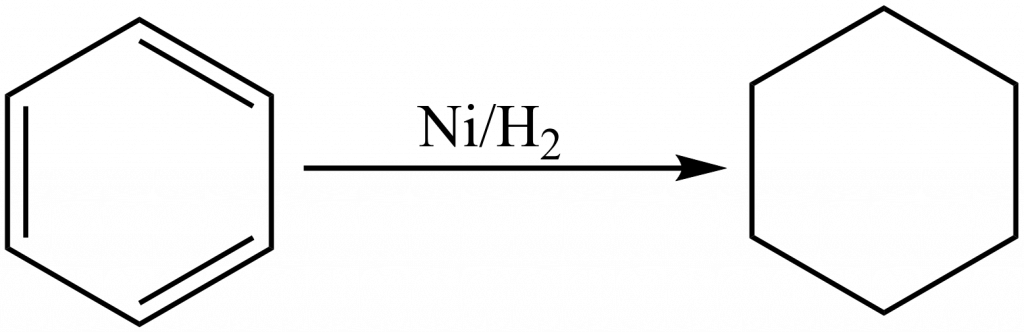
Slitina Ni-Cr
Slitina 90 % niklu s 10 % chromu se využívá při konstrukci termočlánků.
Chemické vlastnosti
Reaktivita niklu je podobná jako reaktivita kobaltu. Rozpouští se ve zředěných minerálních kyselinách, v koncentrované kyselině dusičné se pasivuje. Ve vodných roztocích hydroxidů je kovový nikl stabilní. Oxidace vzduchem probíhá až za vyšší teploty.
Nikl vytváří sloučeniny v oxidačních číslech I, II, III a IV. Nejběžnější jsou sloučeniny nikelnaté. Komplexy NiI jsou vzácné, tento oxidační stav je důležitý pro funkci enzymů, např. [NiFe]-hydrogenasy. Sloučeniny NiIII jsou velmi dobrá oxidační činidla, prvními připravenými sloučeninami s tímto iontem byly trihalofosfiny [Ni(PPh3)X3]. Sloučeniny NiIV jsou vzácné a jejich příprava vyžaduje použití velmi silných oxidačních činidel, příkladem takové sloučeniny je směsný oxid BaNiO3.
Halogenidy
Známe všechny čtyři nikelnaté halogenidy. Bezvodý fluorid nikelnatý lze připravit reakcí bezvodého fluorovodíku s chloridem nikelnatým nebo jeho tetrahydrátem, příp. reakcí fluoru s chloridem nikelnatým při teplotě 350 °C:
NiCl2 + F2 → NiF2 + Cl2
Hydratovaný lze připravit reakcí uhličitanu nikelnatého s roztokem fluorovodíku.


Oxidy
Oxid nikelnatý, NiO, je zelená pevná látka. Není rozpustný ve vodě, krystaluje ve struktuře NaCl. Můžeme ho vyrobit termickým rozkladem uhličitanu nebo dusičnanu nikelnatého. Přímým spalováním niklu v kyslíku NiO nepřipravíme. Oxidace totiž probíhá pouze částečně a vznikají nestechiometrické oxidy.

NMR
| 61Ni | |
|---|---|
| Spin | 3/2 |
| Zastoupení v přírodě [%] | 1,1399 |
| Citlivost vzhledem k 1H | 0,00359 |
| Rezonanční frekvence v poli 1 T | 3,8114 |
Měření 61Ni NMR spekter není úplně triviální, protože jádro má nízké zastoupení i citlivost. Je také kvadrupolární, takže v případě nesymetrického uspořádání okolo Ni centra jsou signály velice široké. Hodnoty chemických posunů závisejí silně na rozpouštědle. Standardem je Ni(CO)4, který je ovšem toxický, proto se častěji využívá Ni(PMe3)4, jehož posun v THF-d8 je 40 ppm, v toluenu-d8 se signál posune na 15,2 ppm, v benzenu-d6 je posun 35 ppm. Velikost jednovazebné interakce je 1J(P-Ni) = 287 Hz.
Hodnoty chemického posunu a interakční konstanty7
| Sloučenina | δ [ppm] | J(61Ni,31P) [Hz] |
|---|---|---|
| Ni(PMe3)4 | 40 | 285 |
| Ni[P(OMe)3]4 | -742 | 398 |
| Ni(PF3)4 | -929 | 482 |
| Ni(PCl3)4 | 267 | 450 |
| Ni(C2H4)2(PMe3) | -866 | |
| Ni(PPh3)4 | 515 | |
| Ni(P(OPh)3)4 | -587 nebo -576 | 400 |
Odkazy
- Komplex [Ni(dppp)(η2-C60)]
- Nikl na české wikipedii
- Nikl na anglické wikipedii
- Ni NMR
- Substituent effects on 61Ni NMR chemical shifts
- Nuclear magnetic resonance and nuclear quadrupole resonance studies of 61Ni in heavy fermion compounds Ce7Ni3
- Structural and Crystallographic Information from 61Ni Solid-State NMR Spectroscopy: Diamagnetic Nickel Compounds
- Action of carbon monoxide on nickel
- Millerit
- Nikelin
- Pentlandit
- Nikl a titan – (ne)známé kovy
- Murray Raney of Chattanooga and nickel catalysts
- HÁLA, Jiří. Radioaktivní izotopy. Tišnov: Sursum, 2013. ISBN 978-80-7323-248-1.
Navigace
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| H | He | ||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr |
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe |
| Cs | Ba | La | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| Fr | Ra | Ac | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |
| Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu |
| Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr |
5 Replies to “Nikl”