Antimon je polokov, který se využívá v polovodičích, různých slitinách, keramice a barvivech. Vykytuje se v oxidačních číslech -3, +3, +4 a +5. Tvoří několik alotropních modifikací – modro-bílý kovový antimon, žlutý a černý nekovový antimon.
| Atomové číslo | 51 | Počet stabilních izotopů | 2 |
|---|---|---|---|
| Atomová hmotnost | 121,760 | Elektronová konfigurace | [Kr] 4d10 5s2 5p3 |
| Teplota tání [°C] | 630,63 | Teplota varu [°C] | 1587 |
| Hustota | 6,697 | Elektronegativita | 2,05 |
Jeho koncentrace v zemské kůře je poměrně malá (0,2-0,5 ppm). Nejdůležitějším minerálem je antimonit (Sb2S3).[5]


Izotopy
Přírodní antimon se skládá ze dvou stabilních izotopů, 121Sb a 123Sb. Známe 35 uměle připravených radioizotopů a mnoho jaderných izomerů.[3,4]
| Izotop | Zastoupení [%] |
| 121Sb | 57,2 |
| 123Sb | 42,8 |
Výroba
Největším producentem antimonu je Čína.[6] Průmyslově se vyrábí ze sulfidických rud pražením a následnou redukcí dřevěným uhlím.
Sb2S3 + 5 O2 → Sb2O4 + 3 SO2
Sb2O4 + 4 C → 2 Sb + 4 CO
Rudy s vysokým obsahem antimonu se zpracovávají jinak, nejprve se získá sulfid antimonitý, který je následně redukován železem.
Sb2S3 + 3 Fe → 2 Sb + 3 FeS
Pro polovodiče se antimon vyrábí chemickou redukcí z vysoce čistých sloučenin. Používá se jako dopant křemíku při výrobě diod, infračervených detektorů a součástkách využívajících Hallův jev.
Sloučeniny
Oxidy
Oxid antimonitý, Sb2O3, je bílá pevná látka. Připravuje se spalováním antimonu na vzduchu nebo pražením sulfidu.
4 Sb + 3 O2 → 2 Sb2O3
2 Sb2S3 + 9 O2 → 2 Sb2O3 + 6 SO2
Je amfoterní, rozpouští se v kyselinách i hydroxidech.
Sb2O3 + 2 NaOH → 2 NaSbO2 + H2O
V plynném stavu vytváří adamantanoidní molekuly, podobně jako P4O10.
Oxid antimoničný, Sb2O5, je žlutá pevná látka. Připravuje se hydrolýzou chloridu roztokem amoniaku nebo oxidací antimonu koncentrovanou kyselinou sírovou. Vytváří antimoničnany, ty krystalují jako oktaedry SbO6 propojené přes vrchol.
Pentahalogenidy
Známe fluorid a chlorid antimoničný, SbF5 a SbCl5. Oba mají geometrii trigonální bipyramidy.
| MX5 | Tt [°C] | Tv [°C] |
| SbF5 | 8,3 | 149,5 |
| SbCl5 | 2,8 | 140,0 |
Fluorid antimoničný je schopen oxidovat kyslík na dioxygenyl, O2+:
2 SbF5 + F2 + 2 O2 → 2 [O2][SbF5]
Na rozdíl od SbCl5, vytváří SbF5, v přítomnosti fluoridů, ochotně větší anionty, např. [Sb2F11]– nebo [Sb3F16]– .
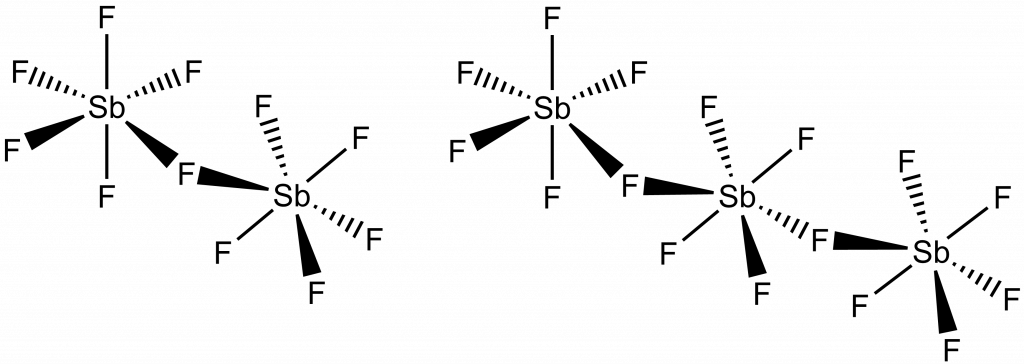
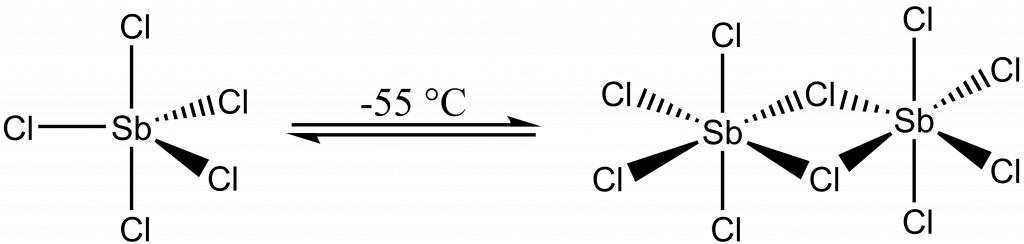
Přídavkem chloridu přechází na hexachloroantimoničnan:
SbCl5 + Cl– → SbCl6–
Reakcí s bezvodým fluorovodíkem vzniká fluorid antimoničný:
SbCl5 + 5 HF → SbF5 + 5 HCl
Superkyseliny
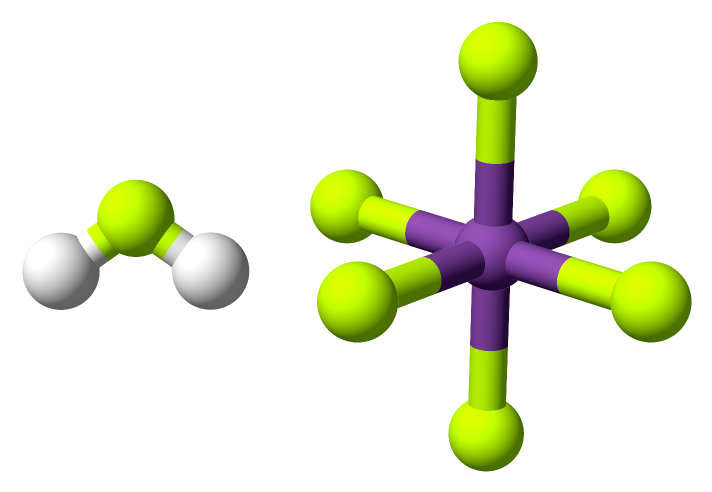
Reakcí s fluoridu antimoničného s fluorovodíkem vzniká kyselina hexafluoroantimoničná, [H2F][SbF6], nejsilnější známá kyselina. Označuje se jako superkyselina.
SbF5 + 2 HF ⇌ H2F+ + SbF6–
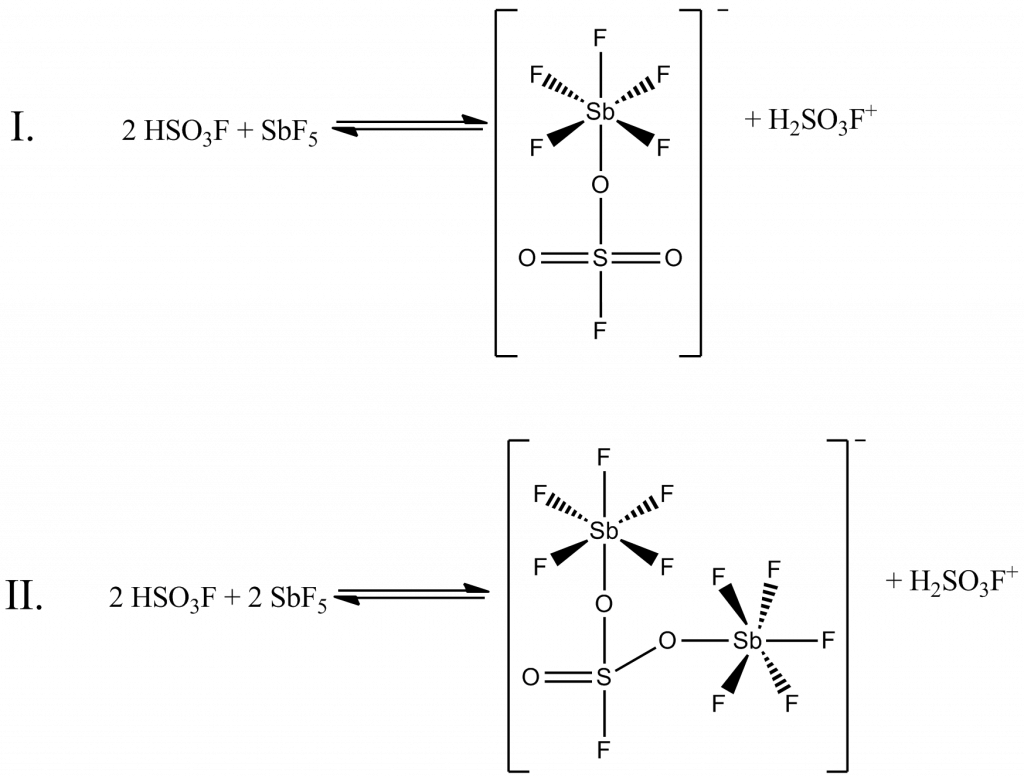
Reakcí s kyselinou fluorsírovou vzniká tzv. magická kyselina. Dochází ke koordinaci volného elektronového páru k antimonu. Podle koncentrace SbF5 vzniká buď adukt 1:1 nebo 1:2. Průběh reakce je možné sledovat pomocí 19F NMR. Kyselost systému lze ještě zvýšit přídavkem tří nebo více molů SO3. Vznikají tak systémy SbF5/HSO3F/SO3, které se označují jako superkyselá média.
NMR
Přírodní antimon je tvořen směsí dvou kvadrupolárních izotopů. Pro měření je výhodný citlivější izotop 121Sb, který má i menší kvadrupolární moment a tím užší linie. Standardem je KSbCl6.
| 121Sb | 123Sb | |
|---|---|---|
| Spin | 5/2 | 7/2 |
| Zastoupení v přírodě [%] | 57,36 | 42,64 |
| Citlivost vzhledem k 1H | 0,0935 | 0,0199 |
| Citlivost vzhledem k 13C | 534 | 114 |
| Rezonanční frekvence v poli 1 T | 10,2551 | 5,5532 |
| Jaderný magnetický moment | +3,3634 | +2,5498 |
Odkazy
- Antimon na české wikipedii
- Antimon na anglické wikipedii
- HÁLA, Jiří. Radioaktivní izotopy. Tišnov: Sursum, 2013. ISBN 978-80-7323-248-1.
- Isotopes of antimony
- Antimonit
- Major countries in worldwide antimony mine production from 2015 to 2022
Navigace
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| H | He | ||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr |
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe |
| Cs | Ba | La | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| Fr | Ra | Ac | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |
| Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu |
| Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr |
3 Replies to “Antimon”