Radon je nejtěžší známý vzácný plyn, jedná se o radioaktivní prvek, který nemá žádný stabilní izotop. Tvoří minimum sloučenin, RnF2 a komplexy typu [RnF]+X– (X– = SbF6–, TaF6–, BiF6–). Je velice dobře rozpustný ve vodě a nepolárních organických rozpouštědlech.
| Atomové číslo | 86 | Počet stabilních izotopů | 2 |
|---|---|---|---|
| Atomová hmotnost | 222 | Elektronová konfigurace | [Xe] 4f14 5d10 6s2 6p6 |
| Teplota tání [°C] | -71 | Teplota varu [°C] | -62 |
| Hustota | 9,73 g.cm-3 | Elektronegativita | – |
Známe 37 radioizotopů v rozmezí 195Rn až 231Rn. Nejstabilnější je 222Rn s poločasem rozpadu 3,823 dne.
| Izotop | Poločas rozpadu | Mechanismu rozpadu | Produkt |
| 210Rn | 2,4 hodin | α | 206Po |
| 211Rn | 14,6 hodin | α | 207Po |
| 222Rn | 3,8235 dne | α | 218Po |
| 224Rn | 1,8 hodin | β− | 224Fr |
Radon se tvoří v půdách a horninách, které obsahují (i stopová množství) uran, postupnými přeměnami 238U vzniká 222Rn. Z horních vrstev půdy se pak radon postupně uvolňuje a může způsobovat zdravotní problémy, pokud dojde k akumulaci v obydlích.
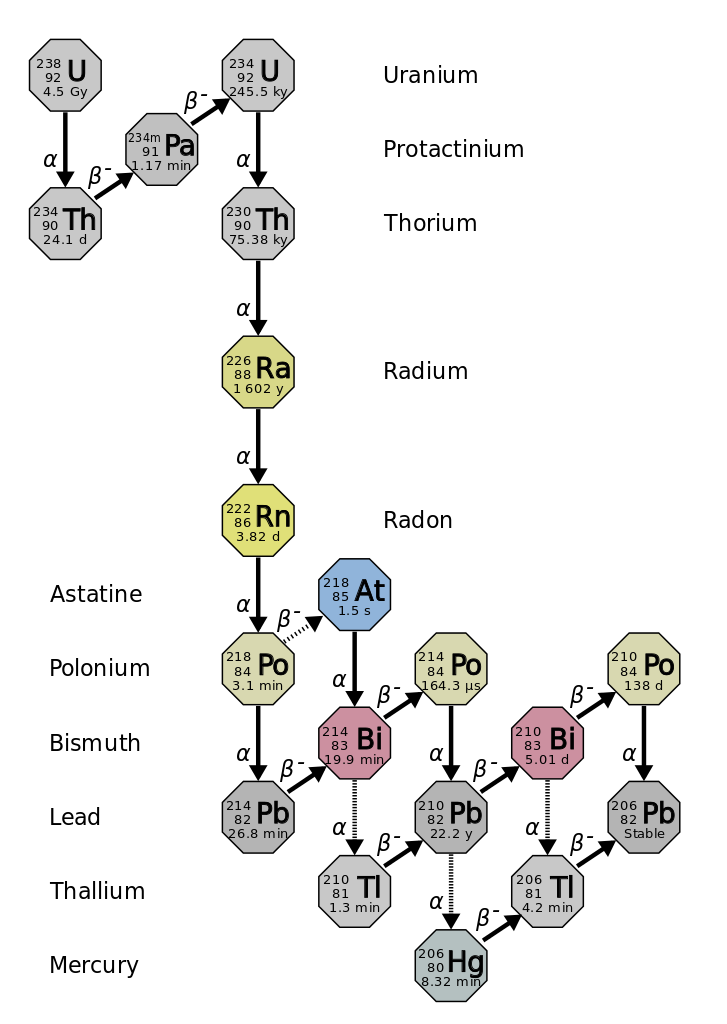
Zdravotní rizika
Zvýšený výskyt radonu může vést až k rakovině plic. Nebezpečné jsou zejména produkty rozpadu, které emitují alfa částice, např. 218Po a 214Po.[5]
Průměrnou koncentraci radonu popisujeme tzv. radonovým indexem.
NMR
| 211Rn | |
|---|---|
| Spin | 1/2 |
| Zastoupení v přírodě [%] | 0 |
| Citlivost vzhledem k 1H | 0,2152 |
| Rezonanční frekvence v poli 1 T | 9,16 |
| Jaderný magnetický moment | +0601 |
Odkazy
- Radon na české wikipedii
- Radon na anglické wikipedii
- Avrorin, V.V.; Krasikova, R.N.; Nefedov, V.D.; Toropova, M.A. Russian Chemical Reviews 1982, 51, 12-20. The Chemistry of Radon. DOI: 10.1070/RC1982v051n01ABEH002787.
- HÁLA, Jiří. Radioaktivní izotopy. Tišnov: Sursum, 2013. ISBN 978-80-7323-248-1.
- Radonové riziko
Navigace
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| H | He | ||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr |
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe |
| Cs | Ba | La | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| Fr | Ra | Ac | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |
| Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu |
| Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr |