Iridium, Ir, je šedivě-bílý drahý kov. Bylo objeveno roku 1803 Smithsonem Tennatem. Je chemicky velmi odolné, rozpouští se pouze v kyselině chlorovodíkové za vysokého tlaku.
| Atomové číslo | 77 | Počet stabilních izotopů | 2 |
| Atomová hmotnost | 192,217 | Elektronová konfigurace | [Xe] 4f14 5d7 6s2 |
| Teplota tání [°C] | 2446 | Teplota varu [°C] | 4428 |
| Elektronegativita | 2,20 | Hustota [g.cm-3] | 22,56 |
Izotopy iridia
Iridium má dva stabilní izotopy. Resp. se předpokládá, že izotopy nejsou stabilní, ale jejich poločas přeměny je tak velký, že zatím nebyl přeměna pozorována. Dále bylo charakterizováno 37 radioizotopů. Nejstabilnějším radioizotopem je 192Ir, poločas přeměny 73,83 dne.
| Izotop | Zastoupení [%] |
| 191Ir | 37,3 |
| 193Ir | 62,7 |
192Ir
Připravuje se ozařováním iridia neutrony v jaderném reaktoru:
$$^{191}_{\ \ 77}\textrm{Ir}\ +\ ^{1}_{0}\textrm{n}\ \rightarrow\ ^{192}_{\ \ 77}\textrm{Ir}\ +\ \gamma$$
Přeměňuje se mechanismem beta mínus na 192Pt, poločas přeměny 73,83 dne:
$$^{192}_{\ \ 77}\textrm{Ir}\ \rightarrow\ ^{192}_{\ \ 78}\textrm{Pt}\ +\ ^{\ \ \ 0}_{-1}\beta^-$$
Využívá se jako zdroj gamma záření v defektoskopii pro kontrolu svarů v potrubí a nádržích.
Výskyt a využití

Iridium je v zemské kůře velmi vzácné, vyšší koncentraci nalézáme v meteoritech. Komerčně se získává z rud niklu a mědi. V současnosti stoupá jeho využití v elektrotechnice. U jeho slitin se využívá vysoké teploty tání a tvrdosti. Dále se využívá v katalyzátorech. Karbonylový komplex iridia se využívá jako katalyzátor v Cativa procesu, kterým se vyrábí kyselina octová z methanolu.
Do roku 1960 bylo iridium součástí slitiny (10 % Ir a 90 % Pt), z které byl vytvořen prototyp metru.[5]
Chemické vlastnosti
Iridium je extrémně odolné vůči korozi, odolává i lučavce královské. Vytváří sloučeniny v intervalu oxidačních čísel -3 až +9.
| Oxidační číslo | Příklad sloučeniny |
| -3 | [Ir(CO)3]3- |
| -1 | [Ir(CO)3PPh3]– |
| 0 | Ir4(CO)12 |
| +1 | [Ir(CO)Cl(PPh3)2] |
| +2 | IrCl2 |
| +3 | IrCl3 |
| +4 | IrO2 |
| +5 | Ir4F20 |
| +6 | IrF6 |
| +8 | IrO4 |
| +9 | [IrO4]+ |
Ion [IrO4]+ je jediný ion s prvkem ve formálním oxidačním čísle +9. Zatím byl pozorován pouze v plynné fázi.[3]
Halogenidy
Fluorid iridičný vytváří cyklické tetramerní molekuly, analogické s NbF5.
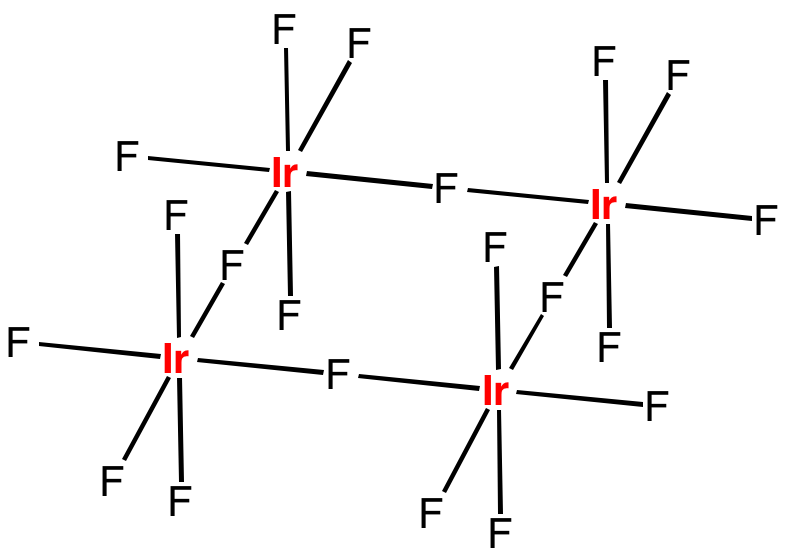
V oxidačním stavu IV známe pouze červený fluorid iridičitý, IrF4. Chlorid zatím nebyl izolován, ale jeho kation [IrCl6]2- je důležitým prekurzorem pro přípravu dalších sloučenin iridia.
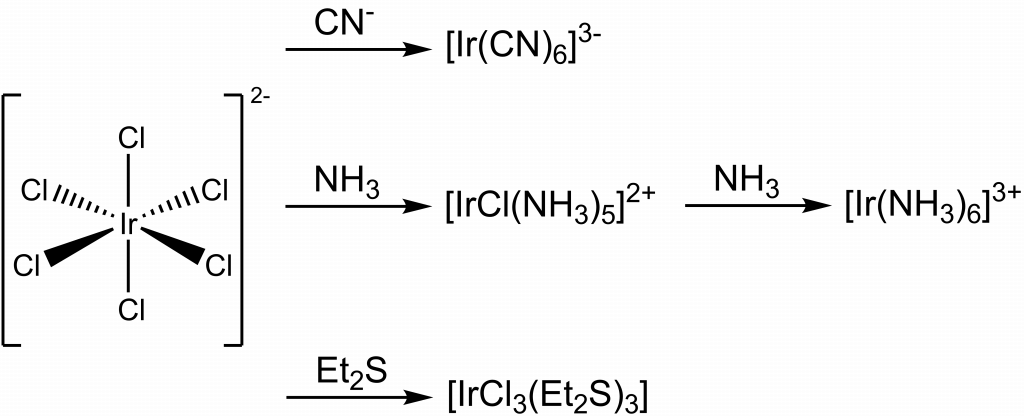
NMR
Oba izotopy iridia jsou NMR aktivní, mají spin 3/2.
| 191Ir | 193Ir | |
| Spin | 3/2 | 3/2 |
| Zastoupení v přírodě [%] | 37,3 | 62,7 |
| Rezonanční frekvence v poli 1 T | 0,7658 | 0,8319 |
| Jaderný magnetický moment | +0,1507 | +0,1637 |
| Citlivost vůči 1H | 2,53×10-5 | 3,27×10-5 |
Odkazy
- Iridium na české wikipedii
- Iridium na anglické wikipedii
- Identification of an iridium-containing compound with a formal oxidation state of IX
- The electronic structure of iridium and its oxides
- Historical context of the SI
Navigace
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| H | He | ||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr |
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe |
| Cs | Ba | La | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| Fr | Ra | Ac | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |
| Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu |
| Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr |
One Reply to “Iridium”