Tento článek je založen na úvodu k mojí disertaci. Třeba to bude někoho zajímat.
Sol-gelové metody jsou používány pro přípravu hlavně anorganických oxidických materiálů a dále pro syntézu organicko-anorganických kompozitních materiálů, které lze jinými metodami získat velmi obtížně. Tyto metody jsou založeny na přípravě koloidní suspenze (solu), který je převeden na viskózní gel a následně na pevný materiál. Tato metoda má mnoho výhod, díky kterým byla využívána dříve, než byly objasněny její základní principy.[1]
Mezi výhody sol-gelových metod patří hlavně nízká reakční teplota, těkavost prekurzorů (alkoxidy), která umožňuje získat výchozí látky o vysoké čistotě, dobrá rozpustnost výchozích látek a mírné reakční podmínky. Nevýhodou těchto procesů je vysoká cena a citlivost některých prekurzorů vůči vodě a kyslíku.
Prvním krokem syntézy je srážení velmi malých částic pevné látky ve formě koloidního solu z vodného nebo nevodného roztoku prekurzoru. Sol je dál transformován na gel, což je porézní, třírozměrná pevná struktura v kapalném prostředí. Gel může být v dalším kroku vysušen konvenční cestou, čímž získáme tzv. xerogel, druhou možností je superkritické sušení, které poskytuje aerogel.
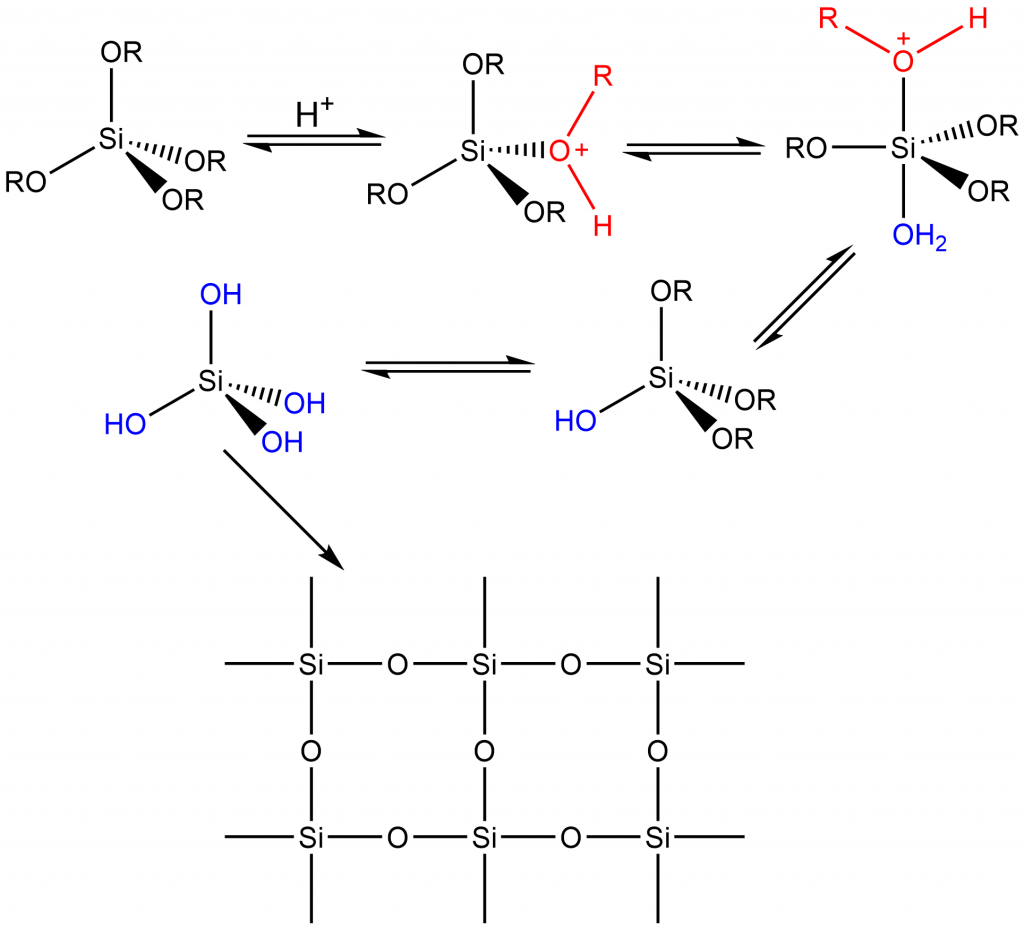
Podle prostředí, ve kterém reakce probíhají rozlišujeme vodné a bezvodé sol-gelové procesy. prvním krokem vodných procesů je hydrolýza, která je následovaná polykondenzací vzniklých hydroxosloučenin. Vodné reakce jsou obecně silně závislé na hodnotě pH prostředí, které je potřeba udržovat na takové úrovni, aby nedocházelo ke srážení.[2]
Hydrolytické sol – gelové metody
Prvním krokem hydrolytických sol-gelových reakcí je hydrolýza prekurzoru:
≡SiOR + H2O → ≡SiOH + ROH
V následujícím kroku dochází ke kondenzaci produktů hydrolýzy mezi sebou nebo s prekurzory:
2 ≡SiOR → ≡Si–O–Si≡ + H2O
≡SiOR + ≡SiOH → ≡Si–O–Si≡ + ROH
Nevýhodou těchto procesů při přípravě směsných oxidických materiálů, např. ZrSiO4, je velký rozdíl v rychlostní konstantě hydrolýzy alkoxidů přechodných kovu a alkoxidů křemíku. Z tohoto důvodu dochází přednostně k vylučování oxidu kovu a nevzniká směsný oxid, ale směs oxidů.
Bezvodé sol-gelové procesy
Sol-gelové procesy probíhající ve vodném prostředí a založené na hydrolýze prekurzorů a následné kondenzaci prekurzorů mají vysokou a obtížně kontrolovatelnou rychlostní konstantu. To mnohdy znemožňuje ovlivnit mikrostrukturu vznikajícího oxidického materiálu. Jednou z možností jak tento problém eliminovat je přejít z vodného prostředí do prostředí organických aprotických rozpouštědel.[3]
Bezvodé sol-gelové procesy se dělí do dvou skupin, podle toho jestli dochází k hydroxylaci nebo k heterofunkčním aprotickým kondenzačním reakcím, kterých se neúčastní hydroxylové skupiny.[4]
Hydroxylační procesy se dále dělí na reakce, při kterých vzniká voda a hydroxylační reakce bez hydrolýzy. Do první skupiny patří reakce při nichž vzniká voda in situ. Jedná se například o dehydrataci terciárních a sekundárních alkoholů nebo esterifikaci. Druhá skupina obsahuje reakce, při nichž vznikají hydroxylové skupiny např. termickou dekompozicí prekurzorů nejčastěji v plynné fázi (CVD, MOCVD), eliminací alkenu z alkoxidu.
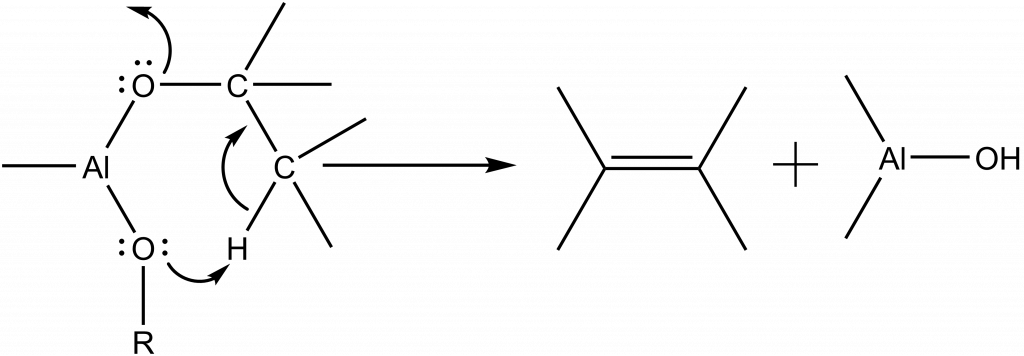
Jako iniciátor hydroxylací se mohou využít např. alkoholy, karbonylové sloučeniny (ketony) atd.
Do druhé skupiny patří aprotické kondenzační reakce, kterých se neúčastní hydroxylové skupiny. Během těchto reakcí dochází k eliminaci malých organických molekul (etherů, esterů, alkylhalogenidů atd.).
M–Cl + M–OR → M–O–M + RCl
M–OR + M–OR → M–O–M + ROR
Příprava fosfátových a fosfonátových materiálů
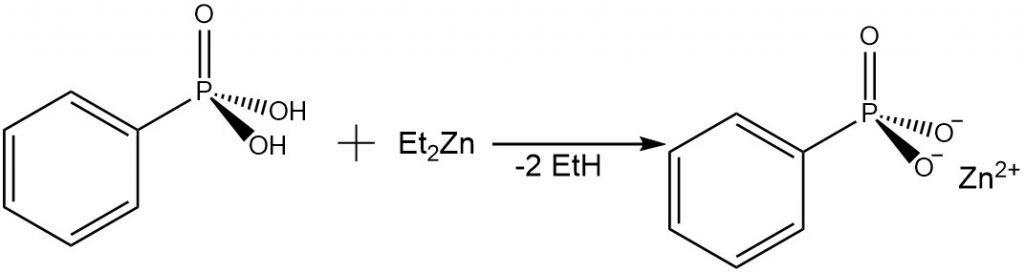
V roce 1999 byla publikována příprava vrstevnatého fosfonátu zinečnatého reakcí kyseliny fenylfosfonové s diethylzinkem. Roztok diethylzinku v toluenu byl pomalu přidán do roztoky fenylfosfonové kyseliny v THF při teplotě −78 °C. Vzniklá směs byla pomalu vytemperována na laboratorní teplotu. Během reakce došlo k eliminaci ethanu. Získaný gel byl vysušen na vzduchu a vzniklý produkt byl identifikován jako [ZnPhPO3]∙H2O.[5]
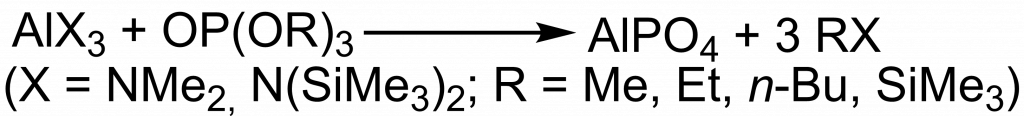
Reakce chloridu hlinitého s tris(trimethylsilyl)fosfátem byla publikována v roce 1998. Po dvou dnech refluxu v THF se vyloučil bílý gel, který byl po promytí a vysušení kalcinován při teplotě 800 °C v kyslíkové atmosféře po dobu 10 h. Po kalcinaci byl získán částečně krystalický produkt, který byl identifikován jako modifikace AlPO4 − tridymit.[6]
AlCl3 + OP(OSiMe3)3 → AlPO4 + Me3SiCl
Reakce triesteru kyseliny fosforečné s amidy hliníku
Reakce triesteru kyseliny fosforečné s amidy hliníku byly popsány v roce 1998.[7] Jejich produktem byl aluminofosfátový gel a příslušný amin. V případě trimethylfosfátu proběhla reakce velmi rychle a byl pozorován slabý exotermní efekt. Zatímco tris(trimethyl)silyl-fosfát reagoval za laboratorní teploty několik hodin. V případe triethyl a tributyl fosfátu bylo nutné provádět reakci za vyšší teploty a po delší dobu.
Literatura
- Hench L.L., West J.K.; Chem. Rev. 1990, 90, 33-72
- Iler, R. K.; The Chemistry of Silica; Wiley: New York, 1955
- Vioux A.; Chem. Mater. 1997, 9, 2292
- Vioux A., Leclercq D.; Heterogen. Chem. Rev. 1996, 3, 65
- Deemie R.W., Muralidhar R., Knight D.A.; J. Organometal. Chem. 1999, 585, 162-166
- Pinkas J., Wessel H., Yang Y., Montero M.L., Noltemeyer M., Fröba M., Roesky H.W.; Inorg. Chem. 1998, 37, 2450-2457
- Graphene aerogel
- Sol-Gel Science and Technology in Context of Nanomaterials – Recent Advances
- The Power of Non-Hydrolytic Sol-Gel Chemistry: A Review
- Nanomaterial by Sol-Gel Method: Synthesis and Application
- Silica aerogels; a review of synthesis, applications and fabrication of hybrid composites
- Porous matrix materials in optical sensing of gaseous oxygen
3 Replies to “Sol-gelové metody”