Molybden, Mo, je přechodný kov, který je důležitou složkou vysoce legovaných ocelí a průmyslových katalyzátorů. Má vysokou teplotu tání a varu, na vzduchu je za laboratorní teploty stabilní, ale při vyšších teplotách se oxiduje, jak kyslíkem, tak halogeny. Jednou z jeho důležitých aplikací je ferromolybden, který se vyrábí aluminotermicky a využívá se v korozivzdorných ocelích. Obsahuje 65-75 % molybdenu a 23-33 % železa.
| Atomové číslo | 42 | Počet stabilních izotopů | 6 |
| Atomová hmotnost | 95,96 | Elektronová konfigurace | [Kr] 4d5 5s1 |
| Teplota tání [°C] | 2623 | Teplota varu [°C] | 4639 |
| Elektronegativita | 2,16 | Hustota [g.cm-3] | 10,28 |
Čistý molybden se vyrábí ve formě prášku a zpracovává se lisováním nebo slinováním za vysokých teplot v redukční atmosféře (H2). Připravený oxid molybdenový se nejprve převede na molybdenan, který se vyčistí, převede na dimolybdenan, a ten se termicky rozloží na oxid, který se následně redukuje vodíkem na kov.
2 MoS2 + 7 O2 → 2 MoO3 + 4 SO2
MoO3 + 2 NH3 + H2O → (NH4)2(MoO4) + H2O
(NH4)2Mo2O7 → 2 MoO3 + 2 NH3 + H2O
MoO3 + 3 H2 → Mo + 3 H2O
Izotopy
V současnosti (2019) známe 33 izotopů molybdenu s atomovou hmotností od 83 do 115. V přírodním molybdenu je obsaženo 9,67 % radioaktivního izotopu 100Mo, s poločasem rozpadu 1,15×1019 let.[4] Prakticky se využívá izotop 99Mo, který se využívá v radioizotopových reaktorech pro získávání 99mTc pro nukleární medicínu.
Výskyt
Molybden se v přírodě vyskytuje ve formě minerálů, které tvoří s jinými prvky. Jeho obsah v zemské kůře je asi 1,5-8 mg.kg-1, v mořské vodě je koncentrace nižší, cca 0,01 mg.dm-3.
Nejdůležitějším minerálem je šesterečný černošedý molybdenit (MoS2), z kterého se pražením vyrábí oxid molybdenový (MoO3). Mletý molybdenit se využívá jako tuhé mazivo, podobně jako grafit.[5] Nacházíme jej v Arménii, Utahu, Coloradu, v česku se nachází např. v Skalsku u Jílového, Ruprechticích a Černé Hoře.
Molybdenit se nejprve praží na vzduchu, za vzniku oxidu, který je extrahován roztokem amoniaku za vzniku molybdenanu amonného.
2 MoS2 + 7 O2 → 2 MoO3 + 4 SO2
MoO3 + 2 NH3 + H2O → (NH4)2MoO4
Molybdenan je pak vyčištěn a převeden na dimolybdenan. Ten je pak termicky rozložen na zpět na oxid, který je přesublimován a redukován vodíkem na kovový molybden.
(NH4)2Mo2O7 → 2 MoO3 + 2 NH3 + H2O
MoO3 + 3 H2 → Mo + 3 H2O
Dalšími rudami jsou wulfenit, PbMoO4 a powellit, Ca(Mo,W)MoO4.
Využití
Asi 86 % molybdenu se využívá v metalurgii, nejčastěji jako přísada do ocelí, zbytek pak v chemickém průmyslu. MoS2 se využívá jako přísada do maziv pro vyšší teploty.
Chemie
Molybden za laboratorní teploty nereaguje ani se vzduchem, ani s vodou. Tvoří sloučeniny v oxidačních stavech II, III, IV, V a VI. Molybden vytváří oxid molybdeničitý a molybdenový a řadu nestechiometrických, výrazně zbarvených oxidů (Mo9O26, Mo8O23, Mo5O14, …). Vytváří i sloučeniny se čtvernou vazbou, např. červenou krystalickou sloučeninu K4[Mo2Cl8].
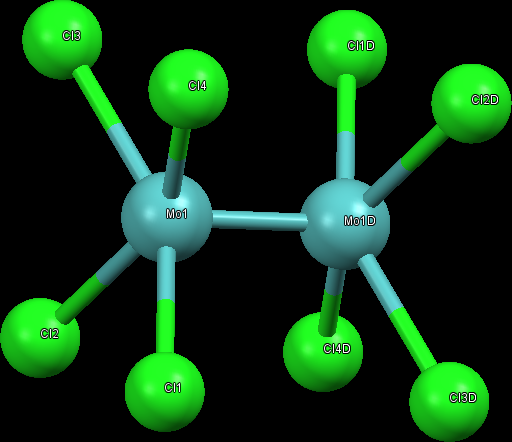

Oxid molybdenový a molybdenany jsou důležité průmyslové katalyzátory, např. pro hydrogenaci benzenu při výrobě cyklohexanu.
Sulfid molybdeničitý, MoS2
Sulfid molybdeničitý, MoS2, je šedočerná pevná látka. V přírodě se vyskytuje jako minerál molybdenit, hlavní surovina pro výrobu molybdenu.
V bulkovém stavu jde o diamagnetickou sloučeninu, která se chová jako nepřímý polovodič. Pokud ho ale převedeme do 2D formy, tzn. připravíme ho jako monomolekulární vrstvu, změní se jeho vlastnosti a získáme přímý polovodič.
2D MoS2 můžeme připravit mechanickou exfoliací nebo i pomocí CVD. Např. reakcí MoO3 se sírou na křemíkovém substrátu.[8]
Biologie
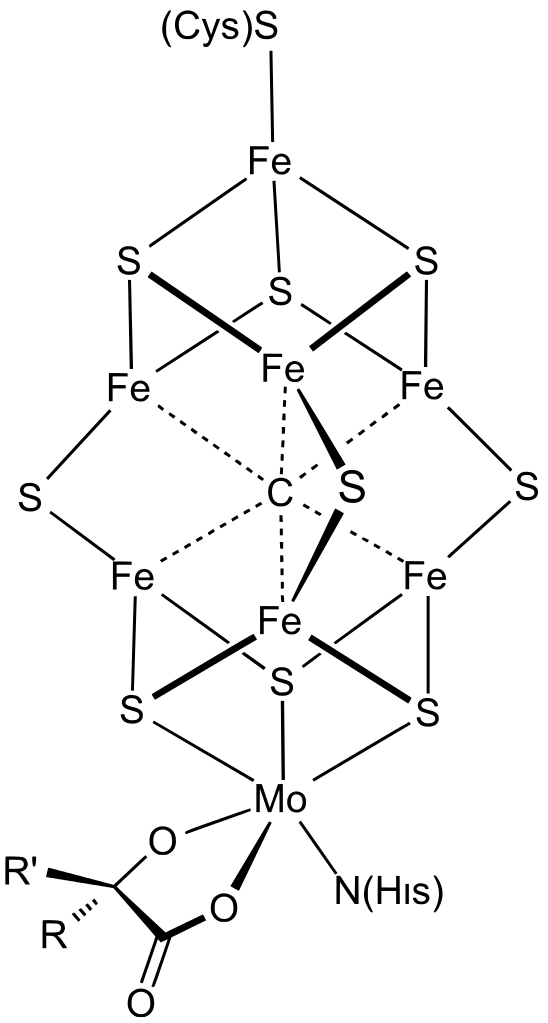
Molybden je esenciálním prvkem pro mnoho organismů, je součástí nejméně padesáti enzymů. Vyskytuje se také v tzv. FeMo kofaktoru,[7] který je součástí nitrogenás, tj. enzymů, které transformují atmosférický dusík na amoniak. Tento kofaktor obsahuje kromě molybdenu taky železo.
NMR
Molybden má dvě NMR aktivní, kvadrupolární jádra – 95Mo a 97Mo. Výhodnější je jádro 95Mo, které je citlivější a poskytuje užší signály. Jako standard se využívá roztok molybdenanu sodného (Na2MoO4) v D2O.
| 95Mo | 97Mo | |
| Spin | 5/2 | 5/2 |
| Zastoupení v přírodě [%] | 15,92 % | 9,55 % |
| Rozsah chemických posunů | -2000 – 2300 ppm | |
| Citlivost vzhledem k 1H | 5,21.10-4 | 3,28.10-4 |
| Citlivost vzhledem k 13C | 3,06 | 20,5 |
| Rezonanční frekvence v poli 1 T | 15,92 | 9,55 |
| Jaderný magnetický moment | -0,9142 | -0,9335 |
Chemické posuny
| Thiokomplexy | 2100-1550 | 6-koordinovaný Mo | 2100-0 |
| Aromatické sandwichové komplexy | 400 – -1900 | 7-koordinovaný Mo | 200 – -2000 |
| Mo(CO)2-4L2-4 | -1000 – 1800 | Mo(CO)5L | -1350 – -1900 |
Odkazy
- Molybden na české wikipedii
- Molybden na anglické wikipedii
- Mo NMR
- HÁLA, Jiří. Radioaktivní izotopy. Tišnov: Sursum, 2013. ISBN 978-80-7323-248-1.
- Molybdenit
- Catalytic properties of MoO3 revisited
- Nitrogenase FeMo cofactor: an atomic structure in three simple steps
- Two-dimensional MoS2: Properties, preparation, and applications
Navigace
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| H | He | ||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr |
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe |
| Cs | Ba | La | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| Fr | Ra | Ac | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |
| Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu |
| Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr |

4 Replies to “Molybden”