Vodík, H, je nejlehčí prvek. Ve vesmíru se jedná o nejrozšířenější prvek. Je to plyn, bez barvy, chuti a zápachu. Se vzduchem (lépe s kyslíkem) tvoří výbušnou směs, tzv. třaskavý plyn. Za laboratorní teploty se slučuje pouze s fluorem, a to za výbuchu. Vyšší reaktivitu vykazuje vodík za zvýšené teploty.
| Atomové číslo | 1 | Počet stabilních izotopů | 2 |
| Atomová hmotnost | 1,008 | Elektronová konfigurace | 1s1 |
| Teplota tání [°C] | -259,125 | Teplota varu [°C] | -252,882 |
| Elektronegativita | 2,1 | Hustota [kg.m-3] | 0,0899 |
Ve sloučeninách s elektronegativnějšími prvky vytváří tzv. vodíkové vazby, klasickým příkladem je voda, která má díky vodíkovým vazbám podstatně vyšší teplotu varu než by odpovídalo trendu ve skupině chalkogenů.
Na Zemi je molekulární vodík poměrně vzácný, vyskytuje se hlavně v blízkosti aktivních sopek. Vodík je ale třetím nejrozšířenějším prvkem na Zemi. Ve vesmíru je vodík nejrozšířenějším prvkem, nachází se v hvězdách a obřích plynových planetách.
Vodík je v chemii velmi důležitý prvek, v protických roztocích vyjadřujeme koncentraci vodíkového kationtu pomocí stupnice pH.
Vodík bude možná v budoucnu hrát důležitou roli v energetice.
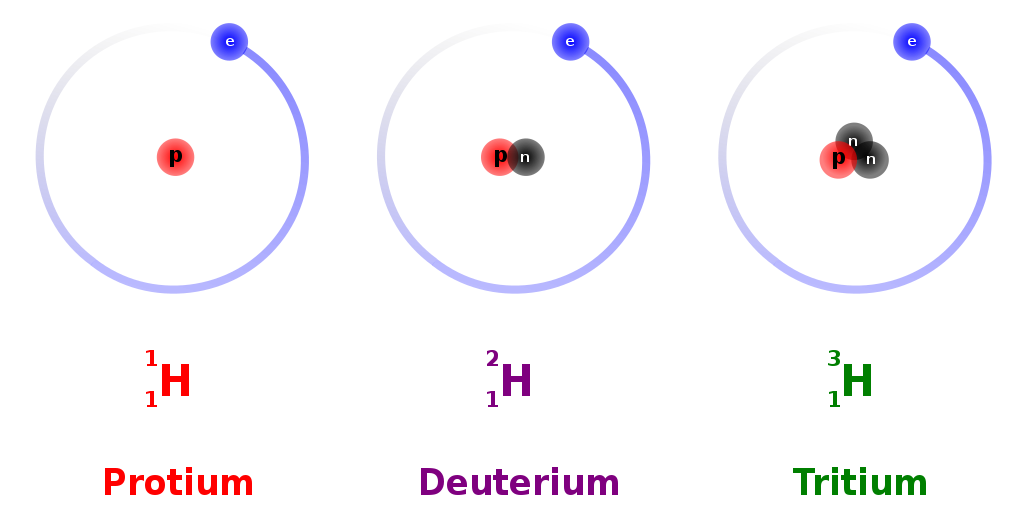
Izotopy
Přírodní vodík se skládá ze tří izotopů, dva jsou stabilní, jeden radioaktivní.
| Izotop | Název | Zastoupení v přírodě | Jaderný spin | Poločas rozpadu |
| 1H | Protium | 99,98 % | 1/2 | Stabilní |
| 2H (D) | Deuterium | 0,02 % | 1 | Stabilní |
| 3H (T) | Tritium | stopové | 1/2 | 12,33 roku |
Deuterium je velmi důležité pro NMR spektroskopii, kde se deuterovaná rozpouštědla využívají pro lockování. Také se používá ke studiu reakčních mechanismů. V současnosti se ukazuje, že by deuterované molekuly mohly být zajímavé i pro farmacii.[9]
Tritium je radioaktivní izotop, v jádře má jeden proton a dva neutrony. Při rozpadu dochází k přeměně neutronu na proton a vyzáření elektronu (β− částice), poločas rozpadu je 4500±8 dní:
$$^3_1\textrm{H}\ \rightarrow\ ^3_2\textrm{He}\ +\ \beta^-$$
Ortho-vodík a para-vodík
Vodík tvoří dvouatomové molekuly, jelikož má atom vodíku nenulový jaderný spin, existují u něj dva jaderně-spinové izomery – ortho–vodík, kde mají obě jádra spiny paralelní, takže výsledný spin je 1 a para-vodík, s nulovým výsledným jaderným spinem. Přechod mezi izomery je možný triplet-singletovým přechodem, který je zakázaný, proto probíhá pomalu. Je ale možné ho katalyzovat např. palladiem nebo platinou. Za nižších teplot je pravděpodobnější vznik para-vodíku, se stoupající teplotou roste i koncentrace ortho-vodíku.[7]
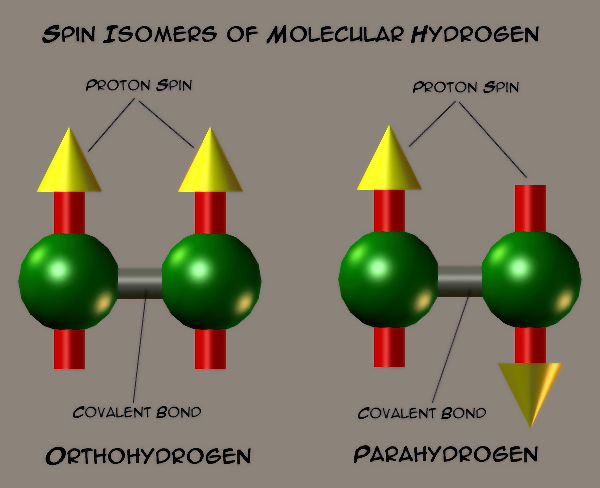
Konverzi mezi těmito izomery lze sledovat i pomocí NMR.
| Teplota [K] | Koncentrace para-vodíku [%] |
| 10 | 99,9999 |
| 20 | 99,821 |
| 50 | 77,054 |
| 100 | 38,620 |
| 200 | 25,974 |
| 300 | 25,072 |
Za vysokých tlaků přestávají být izomery rozlišitelné.[10]
Výroba a příprava
Průmyslově se vodík vyrábí rozkladem zemního plynu při teplotě 1000 °C.
CH4 → C + 2 H2
Lze jej získat i destilací zkapalněného koksárenského plynu nebo svítiplynu, které se získávají při koksování uhlí.
Čistý vodík lze vyrobit i elektrolýzou okyselené destilované vody:
2 H2O → 2 H2 + O2
V laboratoři se nejčastěji připravuje reakcí kovů s minerálními kyselinami, např.:
Zn + 2 HCl → ZnCl2 + H2
Příp. se i v laboratorním měřítku dá využít elektrolýza vody.
Pro hydrogenace organických sloučenin se často využívá tzv. Raneyův nikl, což jsou jemné částice niklu, v kterých je rozpuštěn vodík. Připravuje se rozpouštěním slitiny hliníku a niklu v hydroxidu sodném, nikl s hydroxidem nereaguje, zatímco hliník se rozpouští za uvolnění vodíku, který se nasorbuje na částice niklu:
2 Al + 2 NaOH + 6 H2O → 2 Na[Al(OH)4] + 3 H2
NMR
Vodík tvoří tři NMR aktivní izotopy. Nejčastěji se využívá 1H NMR, protože jeho zastoupení je téměř 100 %, má vysokou citlivost a vyskytuje se ve velkém množství sloučenin. Deuterium 2H (D) se využívá hlavně k tzv. lockování – kompenzaci driftu magnetického pole supravodivého magnetu. Tritium 3H (T) je jediné jádro, které má v daném poli vyšší rezonanční frekvenci než protonové jádro. Ale vzhledem k jeho malému výskytu a radioaktivitě se příliš nevyužívá.
| 1H | 2H | 3H | |
|---|---|---|---|
| Spin | 1/2 | 1 | 1/2 |
| Zastoupení v přírodě [%] | 99,98 | 0,02 | 0,0000000000000003 |
| Citlivost vzhledem k 1H | 1 | 0,00965 | 1,21354 |
| Rezonanční frekvence v poli 1 T | 42,5775 | 6,5359 | 45,4148 |
1H NMR
Jádro 1H ke v NMR nejpoužívanější, jak díky téměř 100% zastoupení v přírodním vodíku, tak i díky vysoké citlivosti. Rozsah jeho chemických posunů je poměrně malý, od zhruba -2 do 18 ppm.
1H NMR posuny
| Látka | Chemický posun [ppm] | |
|---|---|---|
| Cyklopropan | C3H6 | 0,2 |
| Aminy | C-NH2 | 1-5 |
| Alkoholy | -C-OH | 1-5,5 |
| Acetyleny | C≡C-H | 2-3 |
| Iodidy | I-C-H | 2-4 |
| Benzyl | Ar-C-H | 2,2-3 |
| Bromidy | Br-C-H | 2,5-4 |
| Chloridy | Cl-C-H | 3-4 |
| Fenoly | Ar-OH | 4-12 |
| Fluoridy | F-C-H | 4-4,5 |
| Vinyly | C=C-H | 4,6-5,9 |
| Aromatické protony | Ar-H | 6-8,5 |
| Aldehydy | C-C(H)O | 9-10 |
| Karboxylové kyseliny | RCOOH | 10,5-12 |
| Enoly | C=C-OH | 15-17 |
3H NMR
Tritium je jediné jádro, která má v NMR vyšší citlivost než 1H.[11] Komplikací při měření je samozřejmě radioaktivita jádra, která vyžaduje dodržování bezpečnostních pravidel. Díky tomu, že má spin 1/2 jsou spektra velmi podobná spektrům jádra 1H.
Odkazy
- http://chem.ch.huji.ac.il/nmr/techniques/1d/row1/h.html
- Vodík na české wikipedii
- Vodík na anglické wikipedii
- Protonové NMR na wikipedii
- Proton NMR
- 2H NMR on a Bruker AVANCE Spectrometer
- https://www.bnl.gov/magnets/staff/gupta/cryogenic-data-handbook/Section3.pdf
- Scientists are closing in on turning hydrogen into a metal
- Deuterium: Staronová finta farmaceutických chemiků
- Nuclear spin coupling crossover in dense molecular hydrogen
- Tritium NMR: a compilation of data and a practical guide
Navigace
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| H | He | ||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr |
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe |
| Cs | Ba | La | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| Fr | Ra | Ac | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |
| Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu |
| Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr |
22 Replies to “Vodík”