Dusík, N, je za normální teploty plyn bez barvy a zápachu. Má dva stabilní izotopy – 14N a 15N a dva umělé – 13N a 16N.[8] Oba stabilní izotopy jsou důležité v NMR spektroskopii. Dusík je velmi nereaktivní plyn, čehož se využívá např. při práci s látkami citlivými na kyslík a vzdušnou vlhkost. Za laboratorní teploty reaguje pouze s lithiem[2] a plutoniem.[3]
| Atomové číslo | 7 | Počet stabilních izotopů | 2 |
| Atomová hmotnost | 14,0067 | Elektronová konfigurace | [He] 2s2 2p3 |
| Teplota tání [°C] | -210,01 | Teplota varu [°C] | -195,80 |
| Elektronegativita | 3,1 | Hustota [kg.m-3] | 1,2506 |
Za vysokého tlaku vytváří dusík pevný 2D materiál.
Dusík se získává frakční destilací zkapalněného vzduchu. V menším měřítku je možné jej získat pomocí speciálních selektivních membrán, které dokáží dusík separovat od ostatních složek vzduchu. Příp. využít vhodnou reakci, asi nejpoužívanější jsou termický rozklad azidu sodného nebo dusičnanu, příp. dusitanu amonného.
2 NaN3 (s) → 2 Na + 3 N2
NH4NO2(aq) → N2 + 2 H2O
2 NH4NO3(s) → 2 N2 + 2 O2 + 4 H2O
Izotopy
Přírodní dusík se skládá ze dvou stabilních izotopů a stopového množství radioizotopu 13N.
| Izotop | Poločas rozpadu | Zastoupení [%] |
| 13N | 9,965 minut | stopy |
| 14N | stabilní | 99,6 |
| 15N | stabilní | 0,4 |
9N
V roce 2023 byl pozorován exotický izotop 9N, který obsahuje 7 protonů a pouze dva neutrony. Tento izotop byl zachycen v rozpadové řadě izotopu 13O, jeho poločas rozpadu je méně než 1 attosekunda (1 as = 1.10-18 s). Rozpadá se za vzniku jádra 4He a uvolnění pěti protonů.[11]
$$^9_7\textrm{N}\ \rightarrow\ ^4_2\textrm{He}\ +\ 5\ ^1_1\textrm{p}$$
13N
Tento izotop v přírodě vzniká interakcí gamma záření s neutrony jader 14N a 16O:
$$^{14}_{\ \ 7}\textrm{N}\ +\ \gamma\ \rightarrow\ ^{13}_{\ \ 7}\textrm{N}\ +\ ^1_0\textrm{n} \\
^{16}_{\ \ 8}\textrm{O}\ +\ \gamma\ \rightarrow\ ^{15}_{\ \ 8}\textrm{O}\ +\ ^1_0\textrm{n}$$
Poločas přeměny je 9,965 minut, uměle se připravuje ostřelováním vody urychlenými protony:
$$^{16}_{\ \ 8}\textrm{O}\ +\ ^1_1\textrm{p}\ \rightarrow\ ^{13}_{\ \ 7}\textrm{N}\ +\ ^4_2\textrm{He}$$
Využívá se v lékařské diagnostice, ve formě značené molekuly dusíku nebo amoniaku, k vyšetřování dýchacích cest a prokrvení tkání.
16N
Poločas rozpadu 7,13 s. Vyrábí se ostřelováním kyslíku 16O rychlými neutrony.
$$^{16}_{\ \ 8}\textrm{O}\ +\ ^1_0\textrm{n}\ \rightarrow\ ^{16}_{\ \ 7}\textrm{N}\ +\ ^1_1\textrm{p}$$
Měření aktivity 16N v chladící vodě se využívá k regulaci výkonu některých jaderných reaktorů.
Sloučeniny
Amoniak
Amoniak nebo azan (NH3) je jednou z průmyslově nejdůležitějších sloučenin dusíku. Za normálních podmínek je to bezbarvý plyn s charakteristickým, intenzivním zápachem, je silně toxický. V čistém stavu se musí skladovat podchlazený nebo v tlakových nádobách, vzhledem k jeho teplotě varu (−33,3 °C) je možné ho skladovat i ve skleněných ampulích s ventilem. Běžně dostupný amoniak je vodný roztok amoniaku, jeho maximální koncentrace se pohybuje kolem 31 %.
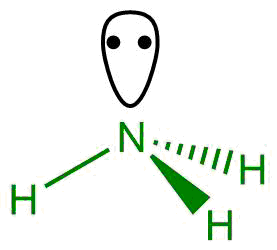
Průmyslově se vyrábí Haber-Boschovým procesem, vyvinutým v první polovině dvacátého století.[9] Tato výroba je energeticky náročná a amoniak se vyrábí v obrovských množstvích (198 miliónů tun v roce 2012),[6] důsledkem toho je, že výroba amoniaku spotřebuje asi jedno procento energie vyrobené člověkem. Tímto procesem se amoniak vyrábí z prvků, vodík a dusík spolu reagují za tlaku 15-25 MPa a teplotě 400-500 °C. Směs plynů prochází přes katalyzátor a dochází ke vzniku amoniaku, účinnost procesu je jen kolem 15 %, ale průmyslové reaktory mají mnoho pater a nezreagovaný plyn se regeneruje, tím se dosahuje účinnosti až 97 %. Neustále se hledají nové a úspornější cesty syntézy amoniaku, zatím se v praxi stále využívá jen Haber-Boschův proces.[10] Už byly položeny základy pro mechanochemickou a fotoelektrochemickou výrobu amoniaku.
N2 + 3 H2 → 2 NH3
Haber-Boschův proces můžeme popsat sérií rovnovážných reakcí. Nejprve dochází k adsorpci plynů na katalyzátor, disociaci a poté k vlastní reakci:
- N2 (g) ⇌ N2 (ads.)
- N2 (ads.) ⇌ 2 N (ads.)
- H2 (g) ⇌ H2 (ads.)
- H2 (ads.) ⇌ 2 H (ads.)
- N (ads.) + 3 H(ads.) ⇌ NH3 (ads.)
- NH3 (ads.) ⇌ NH3 (g)
Oxidy
Známe nejméně sedm binárních sloučenin dusíku s kyslíkem:
- Oxid dusný – N2O
- Oxid dusnatý – NO
- Oxid dusitý – N2O3 ≡ NO.NO2
- Oxid dusičitý – NO2
- Oxid dusičný – N2O5
- Nitrosylazid – N4O
- Trinitramid – N4O6 ≡ N(NO2)3
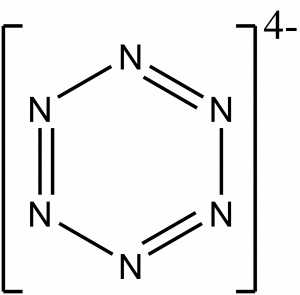
Hexazin
Hexazin je dusíkový analog benzenu, kde jsou všechny uhlíky nahrazeny atomy dusíku. Zatím nebyl připraven, ale v roce 2023 byla publikována příprava aromatického aniontu [N6]4-.
NMR
14N NMR
Jádro 14N je kvadrupól, tzn. že signály jsou rozšířené. To značně ztěžuje měření, zvláště u nesymetrických molekul, výhodou je ale vysoké zastoupení tohoto izotopu v přírodě.
| Spin | 1 |
|---|---|
| Zastoupení v přírodě | 99,63 % |
| Jaderný magnetický moment | +0,4037610 |
| Rozsah chemických posunů | 0 až 900 ppm |
| Relativní citlivost k 1H | 1,01×10-3 |
| Relativní citlivost k 13C | 5,74 |
Jádro 14N může způsobit rozšíření signálů jader v jeho okolí, tomu lze předejít dekaplováním během měření.[7]
15N NMR
15N NMR poskytuje podstatně užší linie, ale pokud nemáme obohacené vzorky, tak je nutné měřit pomocí technik INEPT nebo HSQC, příp. HMBC. Kvůli minimálnímu zastoupení izotopu v přírodním dusíku je citlivost velice nízká.
| Spin | 1/2 |
|---|---|
| Zastoupení v přírodě | 0,368 % |
| Jaderný magnetický moment | -0,2831888 |
| Rozsah chemických posunů | -300 až 900 ppm |
| Relativní citlivost k 1H | 3,85×10-6 |
| Relativní citlivost k 13C | 0,0219 |
Odkazy
- Dusík na české wikipedii
- Dusík na anglické wikipedii
- Surface and Corrosion Chemistry of Plutonium
- Nitrogen NMR
- 15N NMR Spectroscopy in Structural Analysis: An Update (2001 – 2005)
- Market Study Ammonia
- Improved 1H Resolution with 14N Decoupling
- HÁLA, Jiří. Radioaktivní izotopy. Tišnov: Sursum, 2013. ISBN 978-80-7323-248-1.
- Ammonia synthesis: the greatest innovation of the 20th century
- Catalytic N2-to-NH3 (or -N2H4) Conversion by Well-Defined Molecular Coordination Complexes
- Strong Evidence for 9N and the Limits of Existence of Atomic Nuclei
Navigace
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| H | He | ||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr |
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe |
| Cs | Ba | La | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| Fr | Ra | Ac | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |
| Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu |
| Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr |
14 Replies to “Dusík”