V tomto článku se budu věnovat českému názvosloví běžných chemických sloučenin. České chemické názvosloví je zajímavé existencí koncovek pro jednotlivá oxidační čísla, tento koncept poprvé zavedl Vojtěch Šafařík.
Prvky
České názvy některých prvků obsahují zdvojené souhlásky nebo jiné nepravidelnosti (viz tabulka).
| Bohrium, Bh | Curium, Cm | Darmstadtium, Ds | Einsteinium, Es |
| Flerovium, Fl | Hassium, Hs | Kalifornium, Cf | Kopernicium, Cn |
| Livermorium, Lv | Lutecium, Lu | Meitnerium, Mt | Promethium, Pm |
| Rhenium, Re | Rhodium, Rh | Roentgenium, Rg | Ruthenium, Ru |
| Rutherfordium, Rf | Seaborgium, Sg | Tellur, Te | Thallium, Tl |
| Thulium, Tm | Ytterbium, Yb | Yttrium, Y |
| Nové prvky | |||
|---|---|---|---|
| Protonové číslo | Symbol | Český název | Latinský název |
| 113 | Nh | Nihonium | Nihonium |
| 114 | Fl | Flerovium | Flerovium |
| 115 | Mc | Moskovium | Moscovium |
| 116 | Lv | Livermorium | Livermorium |
| 117 | Ts | Tennessin | Tennessine |
| 118 | Og | Oganesson | Oganesson |
Návrhy názvů prvků 113, 115, 117 a 118 byly 28.11. 2016 schváleny IUPACem.
Předpony a přípony
Oxidační číslo je formální náboj, který by atom měl, pokud bychom přisoudili vazebné elektrony elektronegativnějšímu prvku ve vazbě. Součet oxidačních čísel v molekule je nula, v iontu je roven jeho náboji. Podle oxidačního čísla určíme odpovídající příponu.
| Oxidační číslo | Kation | Sůl | Kyselina |
|---|---|---|---|
| I | -ný | -nan | -natá |
| II | -natý | -natan | -natá |
| III | -itý | -itan | -itá |
| IV | -ičitý | -ičitan | -ičitá |
| V | -ičný/-ečný | -ičnan/-ečnan | -ičná/-ečná |
| VI | -ový | -an | -ová |
| VII | -istý | -istan | -istá |
| VIII | -ičelý | -ičelan | -ičelá |
| IX | -utý |
Postup určování oxidačních čísel
U jednodušších sloučenin stačí trocha tréninku a oxidační čísla lze určit rychle, pouhým pohledem. Platí několik základních pravidel:
- Součet oxidačních čísel všech prvků v neutrální molekule je roven nule. U iontů je součet oxidačních čísel roven náboji.
- Vodík se nejčastěji vyskytuje v oxidačním čísle +I, výjimkou jsou hydridy kovů (např. CaH2), kde má oxidační číslo -I.
- Kyslík se nejčastěji vyskytuje v oxidačním čísle -II, výjimkou jsou peroxidy (O22-, -I), superoxidy (O2–, -½) a ozonidy (O3–, -⅓).
Pokud chceme určit oxidační číslo selenu v H2SeO4, vyjdeme z předpokladu, že se jedná o klasickou kyslíkatou kyselinu, tzn. vodík bude mít oxidační číslo I a kyslík -II. Proto platí:
2*1 + x + 4*(-2) = 0
x=6
Jde tedy o kyselinu selenovou. Lze samozřejmě využít i analogie se známou kyselinou sírovou (H2SO4).
U iontů je postup stejný, pro SeO42-
x + 4*(-2) = -2
x = 6
Jde tedy o selenan.
Předpony slouží k vyjádření počtu funkčních skupin nebo molekul rozpouštědla v solvátu.
| ½ | hemi- | 5 | penta- | 10 | deka- |
| 1 | mono- | 6 | hexa- | 11 | undeka- |
| 2 | di- | 7 | hepta- | 12 | dodeka- |
| 3 | tri- | 8 | okta- | 13 | trideka- |
| 4 | tetra- | 9 | nona- | 14 | tetradeka- |
Například:
| CaSO4·½ H2O | hemihydrát síranu vápenatého |
| CuSO4·5 H2O | pentahydrát síranu měďnatého |
Kyseliny a soli
U kyslíkatých kyselin se používá koncovka podle tabulky výše, u bezkyslíkatých používáme opisný název, např. kyselina chlorovodíková, soli mají pak koncovku -id, např. chlorid.
| H2ISVIO-II4 | Kyselina sírová |
| Na2ISVIO-II4 | Síran sodný |
| H3IPVO-II4 | Kyselina fosforečná (trihydrogenfosforečná) |
| K3IPVO-II4 | Fosforečnan draselný |
| NaH2IPVO-II4 | Dihydrogenfosforečnan sodný |
| Na2HIPVO-II4 | Hydrogenfosforečnan sodný |
| AlIIIH3-I | Alan |
| Se-IIH2I | Selan |
| P-IIIH3I | Fosfan |
| P-VH5I | Fosforan |
| HICl-I | Kyselina chlorovodíková |
| H2IS-II | Sulfan |
| H2IO2-I | Peroxid vodíku |
| NaINIIIO-II2∙10H2O | Dekahydrát dusitanu sodného |
| Al2IIIS3-II | Sulfid hlinitý |
| KICIIN-III | Kyanid draselný |
Podvojné soli
Ve vzorcích podvojných solí se kationty uvádějí v pořadí rostoucích oxidačních čísel, v případě stejného oxidačního čísla v abecedním pořadí. Víceatomové kationty, např. NH4+ nebo PH4+ se uvádějí poslední. V názvu se oddělují pomlčkou a pořadí je dáno pořadím ve vzorci.
| K2NH4PO4 | fosforečnan didraselno-amonný |
| NH4MgPO4 | fosforečnan amonno-hořečnatý |
| NaNH4SO4 | síran sodno-amonný |
| KAl(SO4)2 . 12 H2O | dodekahydrát síranu draselno-hlinitého |
Anionty se uvádějí v abecedním pořadí značek prvků, příp. centrálních atomů.
| Ca3(CO3)2F2 | bis(uhličitan)-difluorid trivápenatý |
| Na6ClF(SO4)2 | chlorid-fluorid-bis(síran) hexasodný |
Názvy iontů
Kationty
Názvy jednoatomových kationtů jsou dány koncovkou odpovídající oxidačnímu číslo (např. sodný, vápenatý, …), názvy víceatomových kationtů, vytvořených adicí protonu, se tvoří pomocí přípony -ium.
| PH4+ | fosfonium | H2NO3+ | nitratacidium |
| H3O+ | oxonium | PH4Cl | chlorid fosfonia |
Anionty
Názvy jednoatomových (a některých víceatomových) aniontů se vytvářejí pomocí koncovky -id. Názvy aniontů odvozených od kyslíkatých kyselin se vytváří nahrazením koncového -ý v názvu odpovídajícího kationtu koncovkou -an. Výjimka je pro oxidační číslo VI, kde je záměna ový na an (např. síran).
| H– | hydrid | NH2– | amid |
| F– | fluorid | NH2- | imid |
| Cl– | chlorid | N3- | nitrid |
| O2- | oxid | P3- | fosfid |
| Se2- | selenid | CN– | kyanid |
| SCN– | thiokyanatan | OCN– | kyanatan |
| SeO42- | selenan | ClO– | chlornan |
| ClO2– | chloritan | ClO3– | chlorečnan |
| ClO4– | chloristan | MnO4– | manganistan |
Ionty odvozené z amoniaku
Z amoniaku můžeme odvodit amonný kation, NH4+.
| (NH4)2SO4 | síran amonný |
| NaNH4SO4 | síran sodno-amonný |
| (NH4)Al(SO4)2.12H2O | dodekahydrát síranu amonno-hlinitého |
Substitucí protonů získáme alkylamonné soli:
| (NMe4)2SO4 | síran tetramethylamonný |
| NH2Me2Br | bromid dimethylamonný |

Postupným odštěpováním protonů z amoniaku získáme tři druhy aniontů:
- NH2– – amid
- NH2- – imid
- N3- – nitrid
| LiNH2 | amid lithný | Si(NH2)4 | amid křemičitý |
| Li2NH | imid lithný | CaNH | imid vápenatý |
| Li3N | nitrid lithný | CO(NH2)2 | amid kyseliny uhličité |
| AlN | nitrid hlinitý | SO2(NH) | imid kyseliny sírové |
| Ti3N4 | nitrid titaničitý | SO(NH2)2 | amid kyseliny siřičité |
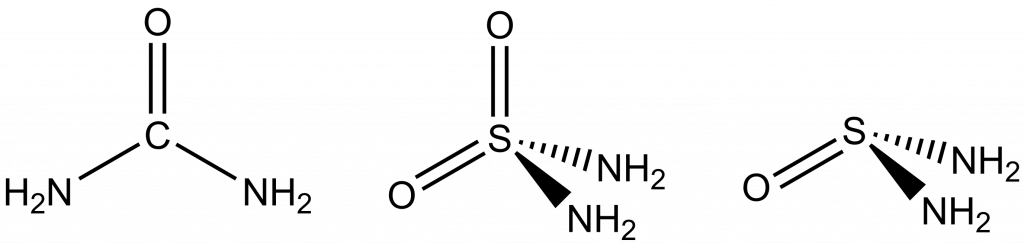
Funkční deriváty kyselin a atomové skupiny
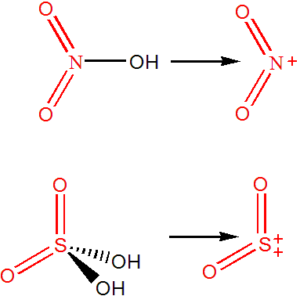
Funkční deriváty kyselin získáme náhradou alespoň jedné OH skupiny v kyselině jinou funkční skupinou, např. Cl– nebo NH2–.
SO2(NH2)2 – diamid kyseliny sírové
SOCl2 – dichlorid kyseliny siřičité
Názvy atomových skupin jsou zakončeny příponou -yl, bez ohledu na náboj nebo oxidační číslo. Pokud existuje více skupin, stejného prvkového složení, ale s rozdílným nábojem, odlišujeme je uvedením náboje, příp. oxidačního čísla centrálního atomu.
| SO | thionyl | NO | nitrosyl |
| SO2 | sulfuryl | NO2 | nitryl |
| S2O5 | disulfuryl | PO | fosforyl |
| SeO | seleninyl | CrO2 | chromyl |
| SeO2 | selenonyl | ClO | chlorosyl |
| OH | hydroxyl | ClO2 | chloryl |
| CO | karbonyl | ClO3 | perchloryl |
| VO | vanadyl | IO2 | jodyl |
| UO2 | uranyl | COCl2 | chlorid karbonylu |
| VOCl | chlorid vanadylu(1+) | UO2NO3 | dusičnan uranylu(V) |
| VOCl2 | chlorid vanadylu(2+) | UO2(NO3)2 | dusičnan uranylu(VI) |
| VOCl3 | chlorid vanadylu(3+) | NOS | sulfid nitrosylu |
Estery
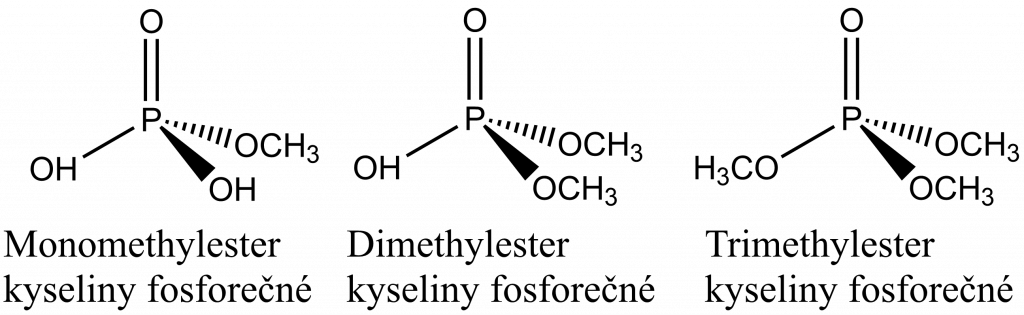
Estery vznikají reakcí kyseliny s alkoholem, proton v OH skupině kyseliny je nahrazen alkylem nebo arylem, na obrázku dole jsou tři možné estery kyseliny fosforečné s methanolem.
Je možné použít i názvosloví odvozené od názvu aniontu PO43-, tzn. od fosfátu. Potom by názvy esterů byly monomethylfosfát, dimethylfosfát a trimethylfosfát.
Izo- a heteropolyanionty
- Izopolyanionty jsou anionty obsahující dva a více centrálních atomů téhož prvku.
- Heteropolyanionty jsou anionty obsahující dva a více centrálních atomů různých prvků.
Vznikají kondenzací monomerních jednotek, např. dichroman vzniká:
2 K2CrO2 + 2 HCl → K2Cr2O7 + H2O + 2 KCl
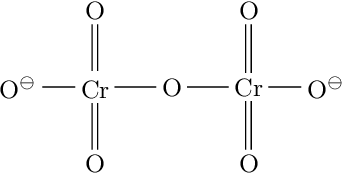
Cyklické a řetězovité struktury odlišujeme předponami cyklo- a katena-. U heteropolyaniontů se názvy jednotlivých složek řadí v abecedním pořadí a oddělují se pomlčkami. Za název se uvádí náboj iontu v závorkách, např.
| (O3CrOAsO2OPO3)4- | anion chromano-arseničnano-fosforečnanový(4-) |
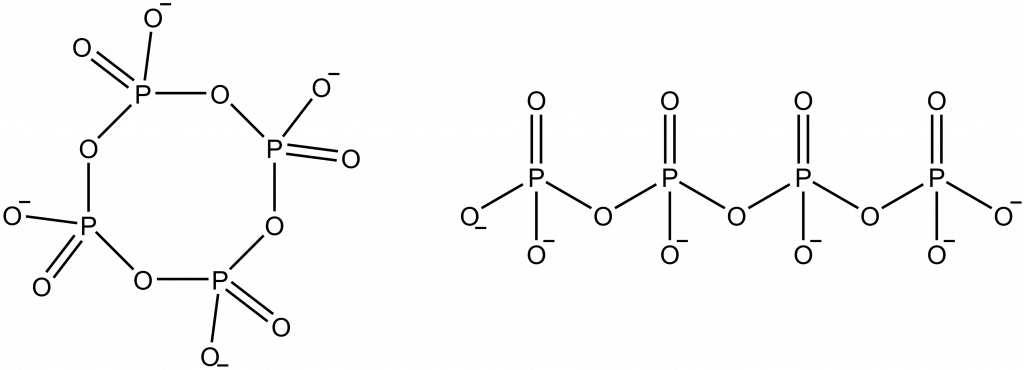
Příklady polykyselin a polyiontů.
Koordinační sloučeniny
Koordinační sloučenina je chemická sloučenina obsahující alespoň jednu donor-akceptorovou vazbu. Skládají se z centrálního atomu, často přechodného kovu, který poskytuje volné orbitaly a ligandů, což jsou atomy nebo skupiny s volnými elektronovými páry.
| Ligand | Název |
| SO42- | Sulfato |
| S2O32- | Thiosulfato |
| PO43- | Fosfato |
| CH3COO– | Acetato |
| F– | Fluoro |
| O2- | Oxido |
| NO– | Nitroso |
| NO2– | Nitro |
| H2O | Aqua |
| NH3 | Ammin |
| CO | Karbonyl |
- [Fe(H2O)6]Cl2 – chlorid hexaaquaželeznatý
- [Fe(H2O)6]Cl3 – chlorid hexaaquaželezitý
- [CO(NH3)5Cl]Cl2 – chlorid pentaamin-chlorokobaltitý
- Na3[Fe(CN)5(H2O)] – aqua-pentakyanoželezitan sodný
- [CO(NH3)5ONO]Cl2 – chlorid pentaamin-nitritokobaltitý
Příklady názvosloví komplexních sloučenin.
SMILES
Tato podkapitola se netýká českého názvosloví, ale stručného zápisu chemických vzorců organických sloučenin, využívá se hlavně pro ukládání struktur v počítačových systémech – databáze, atd. Název SMILES je složen z počátečních písmen „Simplified Molecular Input Line Entry Specification“, koncept byl navržen a publikován roku 1987 Arthurem a Davidem Weiningerem.[1] Později byl upraven a rozšířen společností Daylight Chemical Information Systems[2] a v roce 2007 byl převeden na otevřený standard pod názvem OpenSMILES.[4]
SMILES se zapisují do řádku a popisují typy atomů v molekule a vzájemné vazby mezi atomy a skupinami atomů. Např. ethanol zapíšeme jako CCO, vodíkové atomy jsou vynechány, ethanol je tvořen dvěma uhlíky a kyslíkem, které jsou propojené jednoduchou vazbou. Vodíkové atomy musíme dopočítat. Oxid uhličitý zapíšeme jako O=C=O. Pro trojnou vazbu se používá symbol křížku # a pro čtvernou $. Atomy v aromatických kruzích se zapisují odpovídajícími malými písmeny, benzen zapíšeme c1ccccc1, toluen Cc1ccccc1. Podrobnější pravidla zápisu vzorců pomocí SMILES najdete např. na wikipedii.[3]
Příklady na procvičení
Přiložené PDF obsahuje několik příkladů na anorganické názvosloví. Dokument můžete využít k procvičení, pokud budete chtít příklady opravit, tak mi pošlete sken na email: moravec.zd@gmail.com.
Ke stažení: příklady z názvosloví
Odkazy
- Weininger, D. Smiles, a chemical language and informationsystem. 1. Introduction to methodology and encoding rules. J. Chem. Inf. Comput. Sci. 1988, 28, 31−36.
- http://www.daylight.com/
- https://en.wikipedia.org/wiki/Simplified_molecular-input_line-entry_system
- http://www.opensmiles.org/
- Chemiku, nezlob se: Názvosloví oxidů – chemiku, nezlob se je poutavá hra navržená pro všechny žáky, které nebaví nudná a jednotvárná výuka
Další kapitoly
- České chemické názvosloví
- Platné číslice a měření
- Základní chemické zákony
- Důležité veličiny a vztahy v chemii
- Výpočet stechiometrického vzorce
- Chemické rovnice a stechiometrické výpočty
- Koncentrace roztoků
- Rozpustnost, součin rozpustnosti
- Stavba atomu
- Periodická tabulka prvků a periodicita vlastností
- Chemická vazba
- VSEPR
- Komplexní sloučeniny
- Magnetické vlastnosti látek
- Termodynamika
- Chemická rovnováha
- Skupenské stavy látek
- Fázové rovnováhy
- Teorie kyselin a zásad
- pH, aktivita roztoku
- Elektrochemie
- Symetrie molekul
- Laboratorní technika
- Lineární regrese
- Jednotky tlaku
- Jednotky teploty
- Mohsova stupnice tvrdosti minerálů
- Odkazy
- Prezentace k semináři z obecné chemie
2 Replies to “České chemické názvosloví”