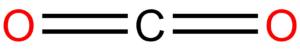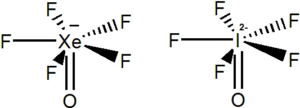Stránka příkladů k teorii VSEPR.
Dva elektronové páry
Tady je situace velmi jednoduchá, molekula je vždy lineární, úhel 180°, např. CO2, CO, atd.
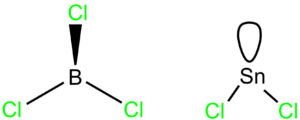
Tři elektronové páry
BCl3
Jde o molekulu AX3, všechny ligandy jsou stejné, proto bude tvar rovnostranný trojúhelník, vazebné úhly budou 120°.
SnCl2
Jde o molekulu AX2E, její tvar bude lomený s úhlem menším než 120° (přesně 95° v plynném stavu).
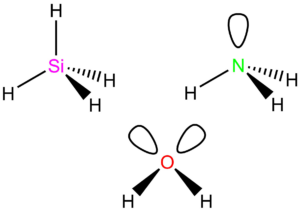
Čtyři elektronové páry
CH4, SiH4, SO42-, atd.
Tyto molekuly (ionty) jsou typu AX4, mají tetraedrický tvar s vazebným úhlem 109,5°.
NH3, PH3, atd.
Typ AX3E, vazebný úhel <109,5° – NH3 (107,8°), PH3 (93,5°). Molekuly mají tvar trojúhelníku.
H2O, H2S, H2Se, H2Te
Typ AX2E2, vazebný úhel <109,5° – H2O (104,5°), H2S (92,1°), H2Se (91°), H2Te (90°). Molekuly mají lomený tvar.
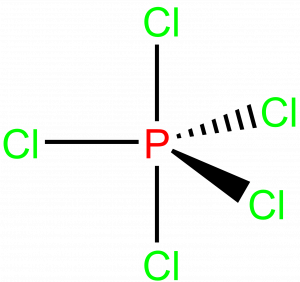
Pět elektronových párů
U molekul AX5 se setkáváme s geometrií trigonální pyramidy, příkladem je třeba PCl5, úhly jsou 90° a 120°
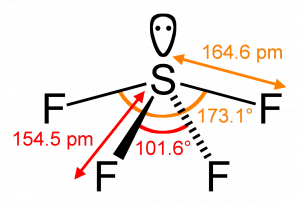
Molekuly AX4E zaujímají tzv. tvar houpačky (viz obrázek), příkladem může být SF4. Volný elektronový pár zaujme pozici v equatoriální rovině, čímž dojde ke zmenšení všech vazebných úhlů. U SF4 jsou vazebné úhly 102° a 173°.

Molekuly typu AX3E2 mají tvar písmene T, s úhlem blízkým 90°. Např. u BrF3 naměříme úhel FBrF 86°, viz. obrázek.
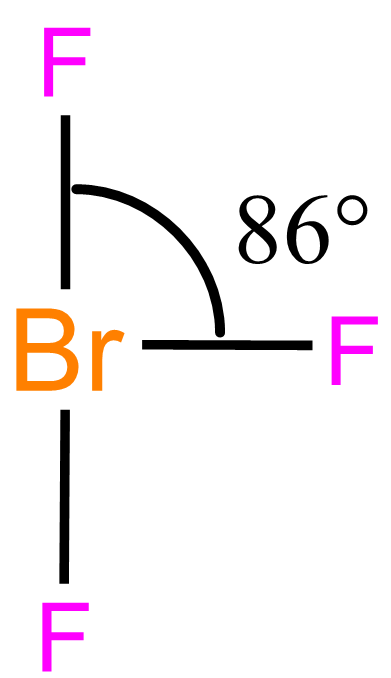
U molekul typu AX2E3 obsazují nevazebné elektronové páry ekvatoriální rovinu, důvodem je nejnižší repulze. Pokud bychom tyto elektronové páry umístili do axiální roviny, tak by úhel mezi nevazebných párem v axiální rovině a párem v ekvatoriální rovině byl jen 90°. Pokud jsou všechny tři nevazebné páry v ekvatoriální rovině, je úhel mezi nimi 120° a úhel mezi nevazebnými a vazebnými páry 90°. Tzn. tvar molekuly bude lineární, příkladem je XeF2.
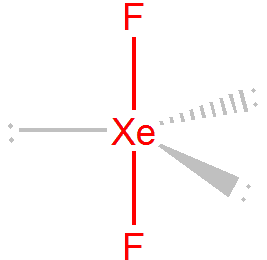
Šest elektronových párů
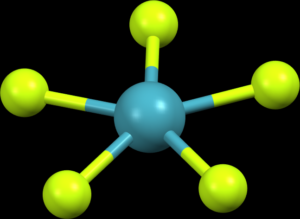
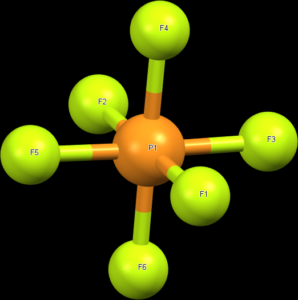
Molekuly a ionty AX6, např. PF6–, mají oktaedrickou geometrii, kde jsou všechny úhly 90°.
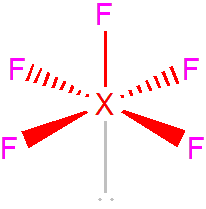
V případě AX5E obsadí nevazebný elektronový pár jeden z vrcholů oktaedru. Dochází také k deformaci úhlů. U ClF5 je úhel přibližně 90°, u BrF5 85° a u IF5 jen 82°.[1]
Sedm elektronových párů
Molekuly a ionty AX7, např. IF7, mají tvar pentagonální bipyramidy, s úhly 72° a 90°.
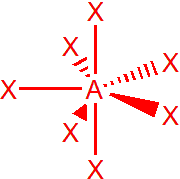
AX6E – XeOF5–, IOF52-
Ionty s obecným vzorcem AX6E mají tvar pentagonální pyramidy, úhly jsou stejné jako u bipyramidy, 72° a 90°.
Inertní elektronový pár
U některých molekul typu AX6E nevazebný elektronový pár neovlivňuje geometrii molekuly a ty jsou oktaedrické. Jde např. o TeCl62- nebo BiCl63-. U XeF6 je energetický rozdíl mezi oktaedrickou geometrií a geometrií tzv. oktaedru doplněného o vrchol (C3v) minimální a tvar molekuly je proměnný.
AX5E2 – XeF5–
Ionty typu AX5E2 jsou planární, mají tvar pětiúhelníku s úhly 72°. Příkladem je anion XeF5– z molekuly [N(CH3)4] XeF5.
Odkazy
Další kapitoly
- České chemické názvosloví
- Platné číslice a měření
- Základní chemické zákony
- Důležité veličiny a vztahy v chemii
- Výpočet stechiometrického vzorce
- Chemické rovnice a stechiometrické výpočty
- Koncentrace roztoků
- Rozpustnost, součin rozpustnosti
- Stavba atomu
- Periodická tabulka prvků a periodicita vlastností
- Chemická vazba
- VSEPR
- Komplexní sloučeniny
- Magnetické vlastnosti látek
- Termodynamika
- Chemická rovnováha
- Skupenské stavy látek
- Fázové rovnováhy
- Teorie kyselin a zásad
- pH, aktivita roztoku
- Elektrochemie
- Symetrie molekul
- Laboratorní technika
- Lineární regrese
- Jednotky tlaku
- Jednotky teploty
- Mohsova stupnice tvrdosti minerálů
- Odkazy
- Prezentace k semináři z obecné chemie