Gallium je poměrně vzácný, nízkotající, diamagnetický kov. Má dva přírodní izotopy 69Ga a 71Ga. Ve sloučeninách se vyskytuje v oxidačních číslech +I, +II a +III. Gallnaté sloučeniny vytvářejí dimerní ion Ga24+, který obsahuje vazbu Ga-Ga.
| Protonové číslo | 31 | Elektronová konfigurace | [Ar] 3d10 4s2 4p1 |
|---|---|---|---|
| Elektronegativita | 1,81 | Počet stabilních izotopů | 2 |
| Teplota tání | 29,7645 °C | Teplota varu | 2204 °C |
Existence gallia byla předpovězena roku 1871 Mendělejevem, potvrzen byl spektroskopicky v roce 1875 Paulem Boisbaudran.
Izotopy
Přírodní gallium se skládá ze dvou aktivních izotopů, dále bylo připraveno a charakterizováno 34 umělých radioizotopů a jaderných izomerů.[6,7]
| Izotop | Zastoupení [%] |
| 69Ga | 60,1 |
| 71Ga | 39,9 |
67Ga
Tento izotop se připravuje ozařováním zinku nebo mědi v cyklotronu:
$$^{68}_{30}\textrm{Zn}\ +\ ^1_1\textrm{p}\ \rightarrow\ ^{67}_{31}\textrm{Ga}\ +\ 2\ ^1_0\textrm{n} \\
^{65}_{29}\textrm{Cu}\ +\ ^4_2\alpha\ \rightarrow\ ^{67}_{31}\textrm{Ga}\ +\ 2\ ^1_0\textrm{n}$$
Přeměňuje se mechanismem elektronového záchytu na 67Zn, poločas přeměny je 3,26 dne. Ve formě citrátu se využívá v nukleární medicíně jako zdroj záření γ.
68Ga
Tento izotop se také přeměňuje mechanismem elektronového záchytu, poločas přeměny je 67,71 minut, vzniká jádro 68Zn.
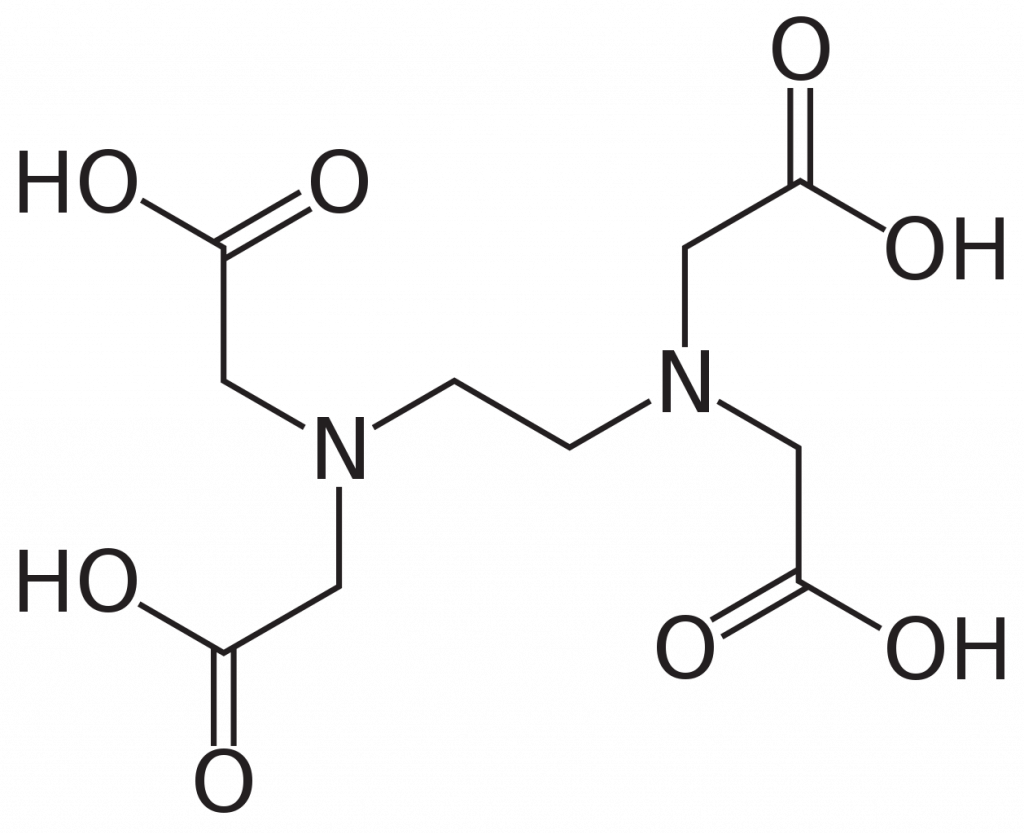
Získává se z generátorů 68Ge/68Ga, k přeměně dochází elektronový záchytem. Germanium je v generátoru fixováno na pevném nosiči, vznikající gallium se izoluje elucí pomocí EDTA (kyseliny ethylendiamintetraoctové) ve formě chelátu.
Chemické vlastnosti
V roce 2015 byl izolován analog benzenu obsahující atom gallia v kruhu.[4]
Oxidy gallia
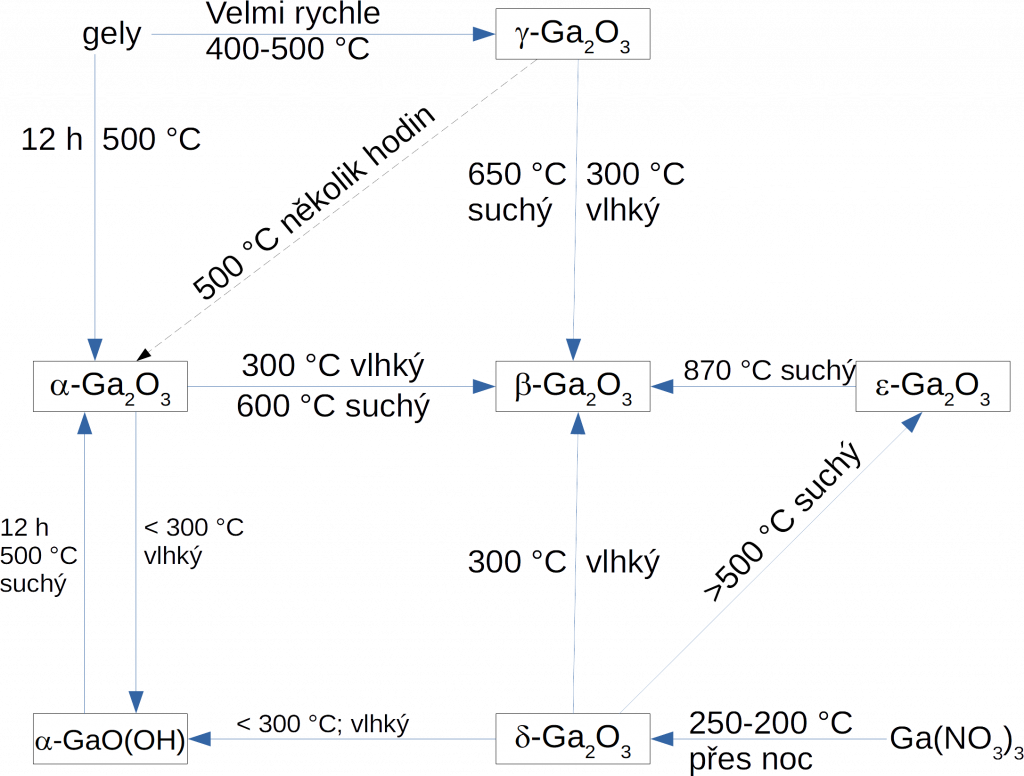
Oxid gallitý (Ga2O3) vytváří pět krystalických modifikací, jejich vztah ukazuje obrázek dole.
Nitrid gallitý

Nitrid gallitý, GaN, je III/V polovodivý materiál, používaný zejména v LED diodách, např. ve fialových laserových diodách pro Blue-ray disky. Pokud GaN dopujeme, tak v závislosti na dopantu můžeme získat různé barvy světla od červené až po ultra-fialovou.[5]
Krystalický GaN se připravuje reakcí taveniny Na/Ga s plynným dusíkem při teplotě 750 °C a tlaku 10 MPa. Práškový pak reakcí kovového gallia nebo oxidu galitého s amoniakem.
2 Ga + 2 NH3 → 2 GaN + 3 H2
Ga2O3 + 2 NH3 → 2 GaN + 3 H2O
Komerčně se krystaly připravují pomocí techniky epitaxe z molekulárních paprsků.
Halogenidy
Fluorid gallitý je bílá pevná látka, taje nad teplotou 1000 °C. Připravuje se reakcí fluoru nebo fluorovodíku s oxidem gallitým nebo tepelným rozkladem hexafluorgallitanu amonného, (NH4)3GaF6.
Ostatní halogenidy mají dimerní strukturu, podobně jako Al2Cl6 a výrazně nižší teploty tání.
| Halogenid | Teplota tání [°C] |
| GaCl3 | 78 |
| GaBr3 | 122 |
| GaI3 | 212 |
Chlorid gallitý se připravuje přímou reakcí z prvků nebo zahříváním oxidu s thionylchloridem:
Ga2O3 + 3 SOCl2 → 2 GaCl3 + 3 SO2
Je to Lewisovská kyselina, využívá se jako katalyzátor v organických reakcích, např. ve Friedel-Craftsových.
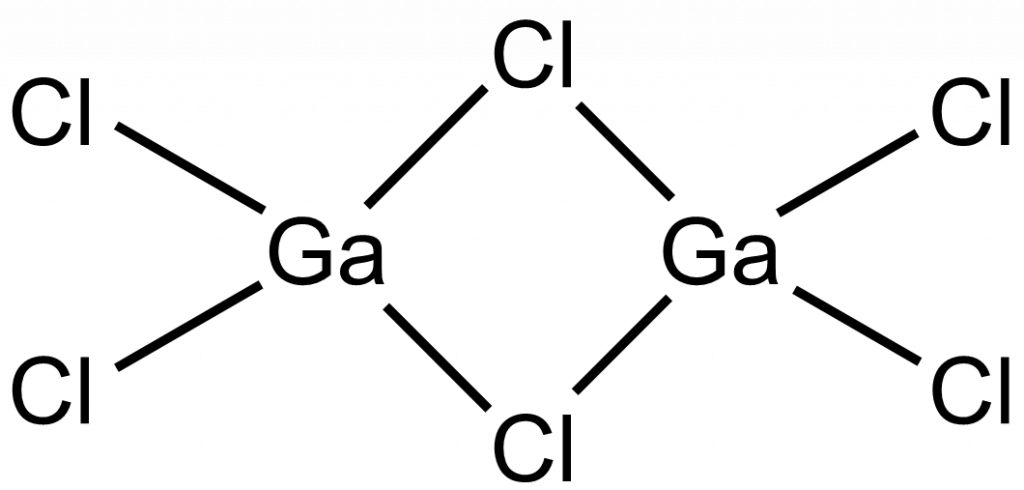
Bromid i jodid gallitý se připravují přímou reakcí z prvků. Bromid gallitý se také využívá jako katalyzátor.
Jodid i chlorid gallitý lze redukovat kovovým galliem na jodid resp. chlorid gallný.
GaI3 + 2 Ga → 3 GaI
Halogenidy gallné jsou podstatně méně stabilní než gallité. Fluorid gallný existuje pouze v plynné fázi.
Zahříváním ekvimolární směsi halogenidu gallitého s kovovým galliem nebo halogenací gallia pomocí Hg2X2 nebo HgX2 lze připravit komplexy GaI[GaIIIX4].
Galliové NMR
Jako standard se využívá roztok Ga(NO3)3 v D2O. Jádro 71Ga poskytuje užší signály a je mírně citlivější, proto se využívá častěji.
| 69Ga | 71Ga | |
|---|---|---|
| Spin | 3/2 | 3/2 |
| Zastoupení v přírodě [%] | 60,11 | 39,89 |
| Rozsah chemických posunů | -710 – 730 ppm | -710 – 730 ppm |
| Citlivost vzhledem k 1H | 0,0419 | 0,0517 |
| Citlivost vzhledem k 13C | 246 | 335 |
| Rezonanční frekvence v poli 1 T | 10,2478 | 13,0208 |
Chemické posuny
| Me3Ga:donor | 700-350 | Methyl chloridy gallité | 380-300 |
|---|---|---|---|
| Šestikoordinované gallium | 20-(-100) | Ga(NO3)3 | 0 |
| Směsné tetrahalogenidy | -50-(-550) | GaI4– | -700 |
Odkazy
- Gallium na české wikipedii
- Gallium na anglické wikipedii
- Gallium NMR
- An Isolable Anionic Gallabenzene: Synthesis and Characterization
- Gallium nitride
- Isotopes of gallium
- HÁLA, Jiří. Radioaktivní izotopy. Tišnov: Sursum, 2013. ISBN 978-80-7323-248-1. S. 126-128
Navigace
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| H | He | ||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr |
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe |
| Cs | Ba | La | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| Fr | Ra | Ac | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |
| Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu |
| Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr |
5 Replies to “Gallium”