Atom je z chemického pohledu nejmenší částice hmoty. Fyzikálními metodami jej ale lze rozštěpit na menší částice. Pro nás budou zajímavé pouze protony a neutrony nacházející se v jádře a elektrony, které se nalézají v elektronovém obalu a jsou odpovědné za vznik chemických vazeb.
Atomové jádro
Atomové je jádro je malá, ale velmi hmotná část atomu. V jádru nalézáme protony a neutrony. Počet protonů označujeme jako protonové (atomové) číslo (Z) a je také jedinečným identifikátorem chemického prvku, píšeme ho jako dolní index před značku prvku – 6C, 7N. Celkový počet protonů a neutronů (nukleonů) se označuje jako nukleonové číslo (A) , píšeme ho jako horní index před značku prvku – \(^{12}_{\ \ 6}\)C, \(^{13}_{\ \ 6}\)C, \(^{14}_{\ \ 7}\)N, \(^{15}_{\ \ 7}\)N.
Prvek – látka skládající se z atomů se stejným protonovým číslem.
Nuklid – látka skládající se z atomů se stejným protonovým a nukleonovým číslem.
Izotopy – atomy prvku s rúzným počtem neutronů, např. \(^{12}_{\ \ 6}\)C, \(^{13}_{\ \ 6}\)C, \(^{14}_{\ \ 7}\)N, \(^{15}_{\ \ 7}\)N.
Radionuklid (radioizotop) – nuklid s nestabilním jádrem. Samovolně se stabilizuje radioaktivním rozpadem.
Jaderný izomer – metastabilní stav jádra, jeden nebo více nukleonů jsou v excitovaném stavu. Stabilizace probíhá buď vyzářením fotonu nebo vnitřní konverzí, kdy se energie z jádra použije k ionizaci atomu. Označuje se písmenem m za nukleonovým číslem, např. 99mTc.[6]
Relativní atomová hmotnost – je dána hmotnostním poměrem atomových hmotností jednotlivých izotopů prvku., např. chlor, který se v přírodě vyskytuje ve formě dvou izotopů: 35Cl, jehož zastoupení je 75,53 % a 37Cl, kterého je 24,47 %. Pak platí:
Ar(Cl) = w(35Cl)A(35Cl) + w(37Cl)A(37Cl) = 0,7553 . 34,97 + 0,2447 . 36,97 = 35,45
Stabilita atomových jader
Na stabilitu atomového jádra má vliv velikost vazebné energie jádra a poměr mezi počtem protonů a neutronů. U lehkých jader je tento poměr zhruba 1:1, se vzrůstajícím protonovým číslem dochází ke zvyšování přebytku neutronů oproti protonům. Nejvíce stabilních jader má protonové i neutronové číslo sudé, např. \(^{12}_{\ \ 6}\)C nebo \(^{16}_{\ \ 8}\)O. Naopak velmi vzácné jsou jádra s lichými počty protonů a neutronů, známe pouze čtyři: \(^1_1\)H, \(^6_3\)Li, \(^{10}_{\ \ 5}\)B a \(^{14}_{\ \ 7}\)N.
Radioaktivní přeměny
Pokud je v jádru nadbytek protonů, jádro se zpravidla samovolně přemění na stabilnější.
α-rozpad: je charakteristický pro těžší jádra, dochází k uvolnění α-částice, tzn. \(^4_2\)He2+, vzniklé jádro má pak protonové číslo nižší o dva a nukleonové o čtyři než původní jádro.
$$^{226}_{\ \ 88}\textrm{Ra} \rightarrow {^{222}_{\ \ 86}}\textrm{Rn} + {^{4}_{2}}\textrm{He}$$
β-rozpad:V případě nadbytku neutronů může dojít k rozpadu neutronu na proton a elektron – částici β– (\(^{\ \ \ 0}_{-1}\)e–) a vzniklé jádro bude mít protonové číslo rovno Z+1 a nukleonové nezměněné.
$$^{32}_{15}\textrm{P} \rightarrow {^{32}_{16}}\textrm{S} + {^{\ \ \ 0}_{-1}}\textrm{e}$$
V případě nadbytku protonů může dojít k rozpadu protonu na neutron a pozitron – β+ (\(^{\ \ \ 0}_{+1}\)e+). Vzniklé jádro bude mít nezměněné nukleonové číslo a protonové číslo bude Z-1.
$$^{11}_{\ \ 6}\textrm{C} \rightarrow {^{11}_{\ \ 5}}\textrm{B} + {^{\ \ \ 0}_{+1}}\textrm{e}$$
Elektronový záchyt – nadbytek protonů v jádře může být kompenzován i elektronovým záchytem, kdy proton zachytí elektron a vznikne neutron a elektronové neutrino (νe).
$${^{1}_{1}}\textrm{p} + {^{\ \ \ 0}_{-1}}\textrm{e}^- \rightarrow {^{1}_{0}}\textrm{n} + \nu_\textrm{e}$$
Vzniklé jádro bude mít protonové číslo rovno Z-1 a nukleonové nezměněné
$$^{7}_{4}\textrm{Be} + {^{\ \ \ 0}_{-1}}\textrm{e} \rightarrow {^{7}_{3}}\textrm{Li}$$
Vzhledem k tomu, že elektrony potřebné k záchytu pochází z elektronového obalu, je poločas reakce závislý na chemickém stavu atomu. Pokud budou elektrony ovlivněny elektronegativním ligandem, budou dále od jádra a pravděpodobnost záchytu se sníží. To lze pozorovat na sérii sloučenin s kyslíkovými ligandy:[7]
| Sloučenina/ion | T1/2 [dny] |
| [Be(H2O)4]2+ | 53,69 |
| Be(OH)2 | 53,42 |
| BeO | 54,23 |
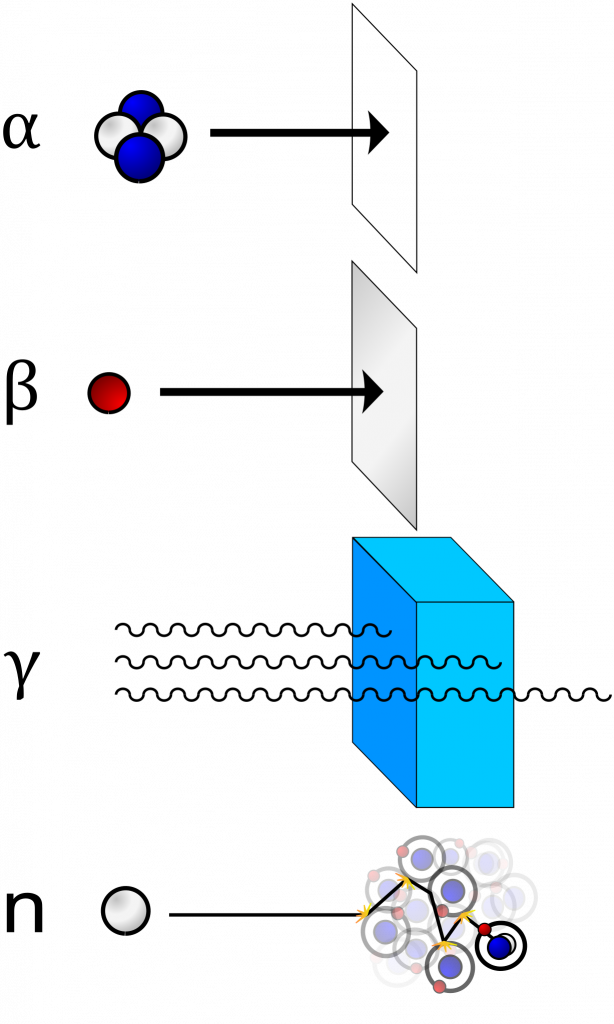
Jednotlivé typy záření se liší svou pronikavostí. Alfa částice jsou tvořeny jádrem helia s dvěma kladnými náboji, proto je snadné je odstínit, stačí na to několik centimetrů vzduchu nebo list papíru. Nebezpečnost tohoto záření je tedy relativně nízká, ale velmi nebezpečná je situace, kdy se alfa zářič dostane dovnitř organismu, kde může způsobit velké poškození.
Beta částice jsou již výrazně menší (elektron nebo pozitron) a nesou jen jeden náboj, na odstínění stačí hliníková fólie nebo třeba jen svrchní vrstva pokožky.
Nejpronikavější je gamma záření, na jeho odstínění potřebujeme několikametrovou vrstvu betonu nebo olověné cihly.
Neutronové záření lze odstínit lehčími jádry, např. vodíkem nebo borem.
Poločas rozpadu
Poločas rozpadu je charakteristika nestabilních jader, udává za jak dlouhou dobu dojde k rozpadu poloviny jader přítomných v systému. Jedná se o pravděpodobnostní veličinu. Jeho velikost se pohybuje od zlomků sekundy až po milióny let.
\\
N(t) = N_0e^{-\lambda t}
\\
t_{\frac{1}{2}} = \frac{\ln 2}{\lambda} = \tau\ln 2$$
N – počet částic; N0 – počet částic v čase 0; λ – rozpadová konstanta; τ – doba života jádra
Hodnota poločasu rozpadu se pohybuje od 10-23 s do více než 1022 let pro izotop 124Xe.
Elektronový obal
Obsahuje elektrony vázané k atomovému jádru. Tvoří asi 0,01 % hmotnosti atomu, ale zabírá většinu jeho objemu. Poloměr elektronového obalu je řádově 10-10 m = Å. V elektronovém obalu se pohybují elektrony, což jsou částice se záporným nábojem a hmotností zhruba 1/1800 hmotnosti protonu. Počet elektronů v neutrálním atomu je shodný s počtem protonů. Bližší info je zde.
Rydbergovy atomu
Jako Rydbergovy atomy se označují atomy s elektrony excitovanými na hladiny s velice vysokou hodnotou hlavního kvantového čísla. Jsou pojmenovány podle švédského fyzika Johannese Roberta Rydberga (1854–1919), který se zabýval studiem vnitřní struktury atomů.

Tyto atomy lze připravit nárazem elektronu (electron impact) nebo interakcí s proudem iontů. Asi nejčastějším způsobem je excitace působením LASERu.
Odkazy
- What is binding energy?
- Co skrývá neutron?
- Rydberg atom
- Kouzla s obřími atomy
- Dependence of the decay rate of 7Be on chemical forms
- Jaderné izomery – záhadné metastabilní stavy jader
- Kvantová fyzika, kvantová komunikace a kosmický výzkum – hodně dlouhý článek, první část je věnována vývoji představ o struktuře atomu
Další kapitoly
- České chemické názvosloví
- Platné číslice a měření
- Základní chemické zákony
- Důležité veličiny a vztahy v chemii
- Výpočet stechiometrického vzorce
- Chemické rovnice a stechiometrické výpočty
- Koncentrace roztoků
- Rozpustnost, součin rozpustnosti
- Stavba atomu
- Periodická tabulka prvků a periodicita vlastností
- Chemická vazba
- VSEPR
- Komplexní sloučeniny
- Magnetické vlastnosti látek
- Termodynamika
- Chemická rovnováha
- Skupenské stavy látek
- Fázové rovnováhy
- Teorie kyselin a zásad
- pH, aktivita roztoku
- Elektrochemie
- Symetrie molekul
- Laboratorní technika
- Lineární regrese
- Jednotky tlaku
- Jednotky teploty
- Mohsova stupnice tvrdosti minerálů
- Odkazy
- Prezentace k semináři z obecné chemie