Lithium, Li, nejlehčí prvek ze skupiny alkalických kovů, je značně reaktivní. Objeveno bylo roku 1817 v aluminosilikátových horninách. Chemicky je bližší spíše kovům alkalických zemin než ostatním alkalickým kovům. Lithné soli barví plamen červeně.
| Atomové číslo | 3 | Počet stabilních izotopů | 2 |
| Atomová hmotnost | 4,002602 | Elektronová konfigurace | 1s2 2s1 |
| Teplota tání [°C] | 180,54 | Teplota varu [°C] | 1342 |
| Elektronegativita | 0,98 | Hustota [kg.dm-3] | 0,534 |
Kovové lithium je velice reaktivní, proto dosud nebyl znám jeho vzhled v čistém stavu. Tým z UCLA dokázal izolovat vysoce čisté lithium ve formě krystalů ve tvaru rombického dodekaedru.[8,9,10]
Izotopy
Lithium má dva stabilní izotopy.
| Izotop | Poločas rozpadu |
| 4Li | 91 . 10-24 s |
| 5Li | 370 . 10-24 s |
| 6Li | stabilní |
| 7Li | stabilní |
| 8Li | 839,40 ms |
| 9Li | 178,3 ms |
| 10Li | 2,0 . 10-21 s |
| 11Li | 8,75 ms |
| 12Li | < 10 ns |
| 13Li | 3,3 . 10-21 s |
6Li se využívá jako výchozí materiál pro výrobu tritia (3H):[7]
$$^{6}_3\textrm{Li}\ +\ ^1_0\textrm{n}\ \rightarrow\ ^{4}_2\textrm{He}\ +\ ^{3}_1\textrm{H}$$
Výskyt a výroba
Obsah lithia v zemské kůře je podstatně nižší než v případě sodíku a draslíku. Ve vesmíru vzniká převážně rozpadem těžších jader, ve hvězdách vzniká během termonukleárních reakcí, ale hned se štěpí na lehčí prvky. V současnosti bylo lithium detekováno i v materiálu vyvrhlého při výbuchu supernovy.[4,5] I když je množství nalezené ve zbytcích po supernově malé, mohlo by se jednat o majoritní zdroj lithia ve vesmíru.
Lithium se vyrábí elektrolýzou směsi 55 % LiCl, 45 % KCl při teplotě 450 °C. Odhaduje se, že celosvětově je k dispozici zhruba 34 200 t lithia v minerálech.[6] Hlavní naleziště jsou v Chile a Argentině. V roce 2013 se 40 % lithia spotřebovalo na výrobu baterií a akumulátorů, 29 % na mazací tuky, ostatní využití lithia je již pod 10 % spotřeby.
Chemické vlastnosti
Za laboratorní teploty reaguje s plynným dusíkem na nitrid lithný Li3N. Stejně jako ostatní alkalické kovy se lithium rozpouští v kapalném amoniaku za tvorby silně redukčního roztoku obsahujícího solvatovaný elektron. Při oxidaci v dostatku kyslíku poskytuje lithium oxid lithný s příměsí peroxidu.
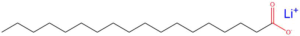
V současné době se ve velkém vyrábí asi 34 sloučenin lithia, hlavní průmyslové využití nachází lithium ve formě stearanu lithného (CH3(CH2)16COOLi), který se využívá v tzv. lithiovém tuku (Lithium grease). Ten je důležitým zahušťovadlem a želatinovací látkou pro převod průmyslových olejů na mazací tuky. Lithium dále nachází velké využití při výrobě akumulátorů, např. LiPol, Li-ION. Využívá se i při výrobě keramiky, slitin a speciálních skel. Ve farmacii se používá LiCO3 pro léčbu maniodepresivních poruch.
Zahříváním lithia v kyslíku nebo nadbytku vzduchu vzniká oxid lithný:
4 Li + O2 → 2 Li2O
Oxid lithný s vodou reaguje za vzniku hydroxidu lithného:
Li2O + H2O → 2 LiOH
NMR
6Li NMR
Jádro 6Li je kvadrupolární, ale díky nízkému kvadrupolovému momentu poskytuje poměrně úzké signály, ale má nízké zastoupení v přírodě, tzn. že i nízkou citlivost.
| Spin | 1 |
|---|---|
| Zastoupení v přírodě | 7,59 % |
| Jaderný magnetický moment | +0,8220467 |
| Rozsah chemických posunů | -16 až +11 ppm |
| Relativní citlivost k 1H | 6,45×10-4 |
| Relativní citlivost k 13C | 3,79 |
7Li NMR
Jádro 7Li NMR má kvadrupólový moment větší, takže linie jsou širší. U sloučenin s lithným iontem se to ale příliš neprojeví, protože je symetrický.
| Spin | 3/2 |
|---|---|
| Zastoupení v přírodě | 92,41 % |
| Jaderný magnetický moment | +3.25644 |
| Rozsah chemických posunů | -16 až +11 ppm |
| Relativní citlivost k 1H | 0,271 |
| Relativní citlivost k 13C | 1721 |
Chemické posuny
Standardem je roztok LiCl v D2O.
| Posun | Sloučenina |
|---|---|
| 11-9 | LiNH2 v kapalném amoniaku |
| 3-(-3) | Vodné roztoky Li+ |
| 0-(-10) | Alkyllithné sloučeniny |
| -10-(-13) | Roztoky Li+ v kapalném amoniaku |
Odkazy
- Lithium na české wikipedii
- Lithium na anglické wikipedii
- Lithium NMR
- Classical Nova Explosions are Major Lithium Factories in the Universe
- First detection of lithium from an exploding star
- Lithium – Statistics and Information
- Fusion Neutrons: Tritium Breeding and Impact on Wall Materials and Components of Diagnostic Systems
- True Shape of Lithium Revealed for the First Time in UCLA Research
- Ultrafast deposition of faceted lithium polyhedra by outpacing SEI formation
- Chemici konečně zjistili, jaký tvar má vlastně lithium
Navigace
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| H | He | ||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr |
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe |
| Cs | Ba | La | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| Fr | Ra | Ac | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |
| Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu |
| Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr |

6 Replies to “Lithium”