Sloučeniny alkalických kovů mají zpravidla iontový charakter a jsou špatně rozpustné v organických rozpouštědlech. To komplikuje jejich využití při syntéze.
Běžným řešením je využití crown-etherů nebo kryptandů, které ion alkalického kovu chelatují a umožní tak jeho přechod do organické fáze.
Crown-ethery
Jak je slyšet z názvu, jedná se o molekuly s tvarem podobným koruně, které obsahují etherové skupiny (R-O-R).
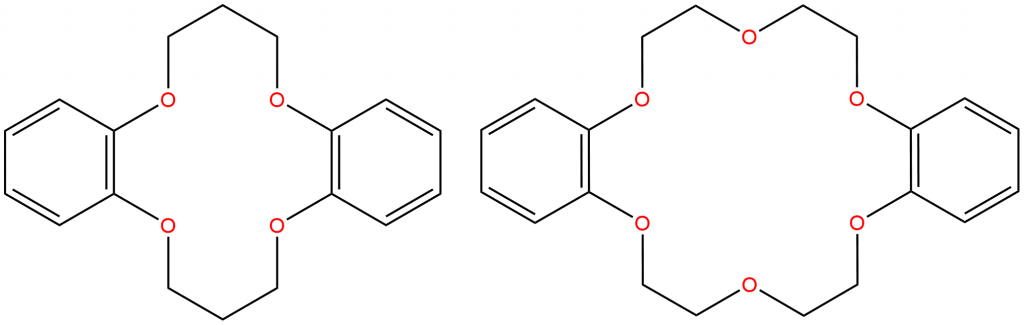
Na obrázku vidíme dva crown-ethery, první je dibenzo-14-crown-4 a druhý dibenzo-18-crown-6. První číslo v názvu označuje počet atomů v cyklu a druhé počet kyslíků v endocyklických etherových vazbách.
Díky přítomnosti více donorových atomů se jedná o ligandy schopné chelatace, velikost kavity uvnitř cyklu odpovídá velikosti chelatovaných iontů.
| Kation | Iontový průměr [pm] | Crown-ether | Průměr kavity [pm] |
| Li+ | 152 | 14-crown-4 | 120 – 150 |
| Na+ | 204 | 15-crown-5 | 170 – 220 |
| K+ | 276 | 16-crown-6 | 260 – 320 |
| Rb+ | 304 | 21-crown-7 | 340 – 430 |
| Cs+ | 334 | dibenzo-30-crown-10 |
Kryptandy
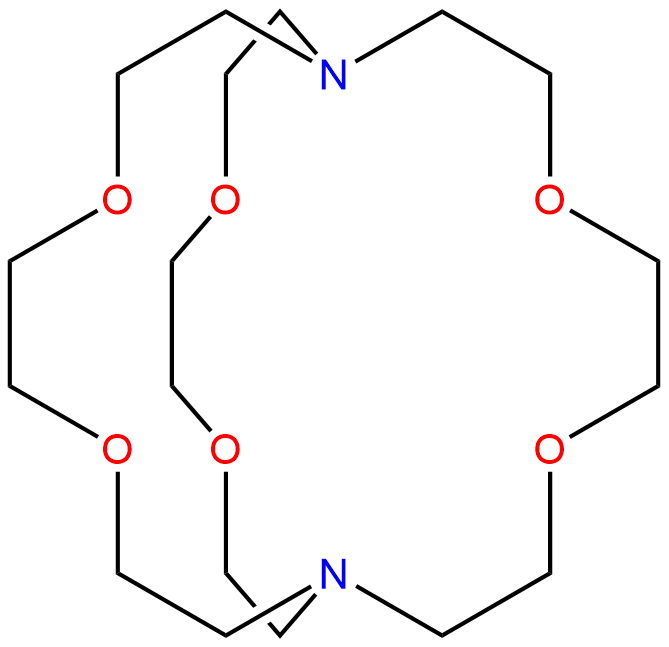
Kryptandy jsou skupina polycyklických sloučenin multidentátních ligandů. Dokáží chelatovat ionty alkalických kovů podobně jako crown-ethery. Jeden z nějběžnějších kryptandů je označován jako (2.2.2)-kryptand (crypt-222 nebo [2.2.2]cryptand), jeho systematický název je 4,7,13,16,21,24-hexaoxa-1,10-diazabicyklo[8.8.8]hexakosan, struktura je na obrázku dole.
Literatura
- Chemie prvků. Praha: Informatorium, 1993, s. 125-130. ISBN 80-85427-38-9.
- Crown ether
- GOFF, Christopher M., Michael A. MATCHETTE, Nahid SHABESTARY a Sadegh KHAZAELI. Complexation of caesium and rubidium cations with crown ethers in N,N-dimethylformamide. Polyhedron. 1996, 15(21), 3897-3903. DOI: 10.1016/0277-5387(96)00018-6. ISSN 02775387.
- Cryptand