Chrom, Cr, je kov z 6. skupiny PSP. Je to velmi tvrdý, ale křehký kov. Využívá se jako součást slitin a antikorozní povrchová úprava.
| Atomové číslo | 24 | Počet stabilních izotopů | 3 |
| Atomová hmotnost | 51,9961 | Elektronová konfigurace | [Ar] 3d5 4s1 |
| Teplota tání [°C] | 1906 | Teplota varu [°C] | 2670 |
| Elektronegativita | 1,66 | Hustota [g.cm-3] | 7,15 |
Kovový chrom je za laboratorní teploty poměrně stabilní, ale rozpouští se ve zředěné kyselině chlorovodíkové a sírové. V přírodě se vyskytuje jako součást železných rud. Důležitým minerálem chromu je krokoit PbCrO4. Za laboratorní teploty je antiferomagnetický, jeho Néelova teplota je 38 °C. Nad touto teplotou je paramagnetický.
Izotopy
Přírodní chrom má čtyři stabilní izotopy a je známo 22 umělých radioizotopů.[10]
| Izotop | Zastoupení [%] |
| 50Cr | 4,34 |
| 52Cr | 83,80 |
| 53Cr | 9,50 |
| 54Cr | 2,36 |
| Izotop | Poločas přeměny |
| 48Cr | 21,6 hodiny |
| 49Cr | 42,3 minuty |
| 51Cr | 27,70 dne |
| 55Cr | 3,50 minuty |
| 56Cr | 5,94 minuty |
51Cr
Izotop 51Cr je radioizotop chromu s nejdelším poločasem přeměny, 27,70 dní. Přeměňuje se záchytem elektronu na 51V.
Připravuje se ostřelováním izotopu 50Cr neutrony, zpravidla se využívá kovový chrom nebo oxid chromitý (Cr2O3) obohacený tímto izotopem, aby byl výtěžek dostatečný.
$$^{50}_{24}\textrm{Cr + }^1_0\textrm{n}\ \rightarrow\ ^{51}_{24}\textrm{Cr + }\gamma$$
Využívá se jako radioaktivní značka, diagnostické radiofarmakum a také v hematologii ke studiu červených krvinek.
Využití
Většina chromu se využívá ve slitinách, menší část pak i v chemickém průmyslu.
Slitina Ni-Cr
Slitina 90 % niklu s 10 % chromu se využívá při konstrukci termočlánků.
Sloučeniny
Ve sloučeninách se vyskytuje převážně v oxidačním stavu II, III a VI, přičemž sloučeniny CrVI jsou karcinogenní. Nejstabilnějším oxidačním stavem je III.
Oxidační stav VI
V oxidačním stavu VI se s chromem setkáváme u chromanů a dichromanů.
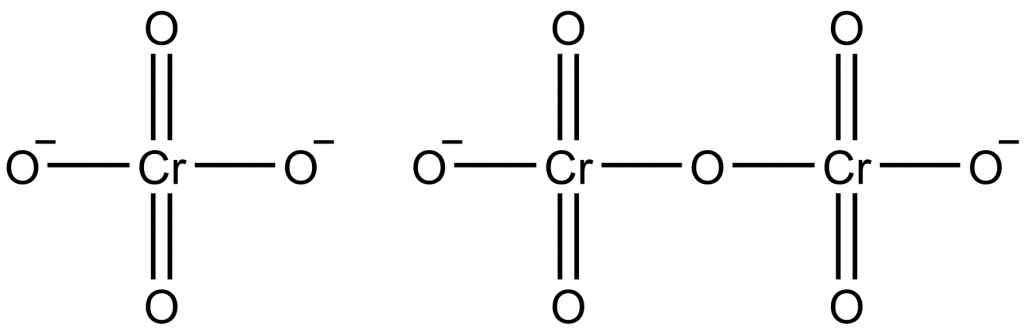
Chromany jsou zpravidla žluté, dichromany pak oranžové. Chroman můžeme na dichroman převést okyselením jeho vodného roztoku, zpět se pak dostaneme přídavkem hydroxidu:
2 K2CrO4 + 2 HCl → K2Cr2O7 + 2 KCl + H2O
K2Cr2O7 + 2 KOH → 2 K2CrO4 + H2O

Dichroman draselný se využívá jako odměrný roztok v bichromatometrii.
Dichroman amonný lze velmi snadno a efektně termicky rozložit za vzniku oxidu chromitého, dusíku a vody. Během této reakce dochází k tzv. vnitřnímu hoření, dichromanový anion je oxidovadlo a amonný kation redukovadlo.
(NH4)2Cr2O7 (s) → Cr2O3 (s) + N2 (g) + 4 H2O (g)
Halogenidy chromylu
Fluorid chromylu, CrO2F2, je fialová, pevná látka. Jeho tavenina je zbarvená do červena. Poprvé byl popsán již roku 1952, kdy byl připraven reakcí oxidu chromového s fluorovodíkem:[6]
CrO3 + 2 HF → CrO2F2 + H2O
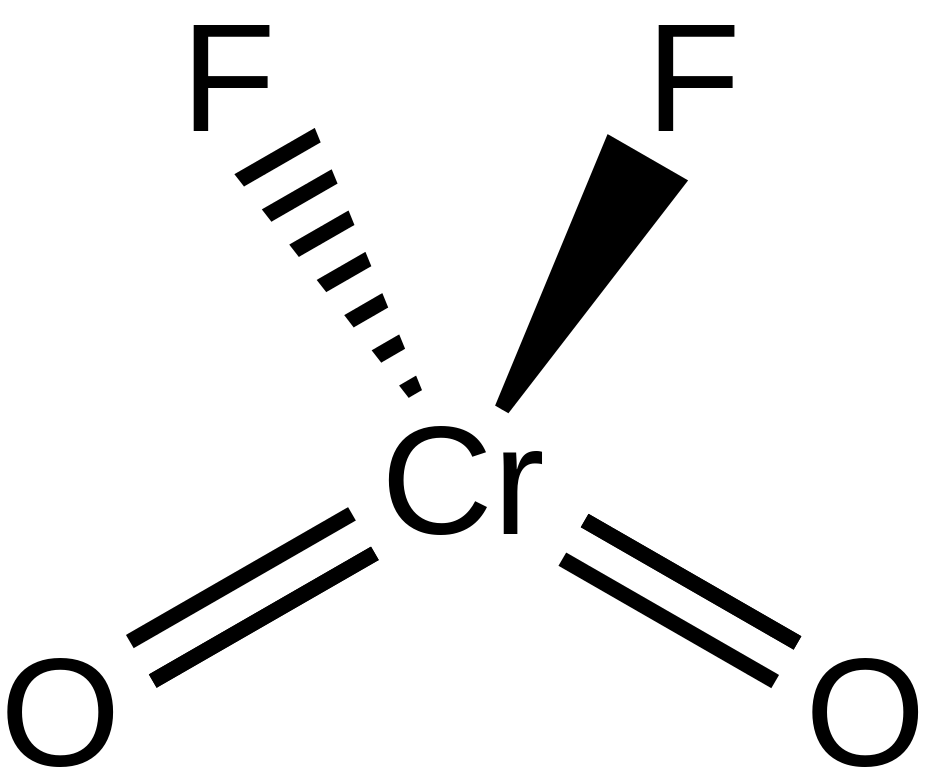
Je to velmi silné oxidační a fluorační činidlo, proto s ním lze manipulovat pouze v plastových lahvích bez obsahu kovů a křemíku:[7]
CrO2F2 + MO → MF2 + CrO3
CrO2F2 + 2 MF → M2[CrO2F4]
Reaguje i s Lewisovými kyselinami, dokáže např. vyvázat organickou kyselinu z jejího anhydridu a vytvořit acylfluorid:[7]
CrO2F2 + 2 (CF3CO)2O → (CF3COO)2CrO2 + 2 CF3COF
Chlorid chromylu, CrO2Cl2, je červenonědá kapalia, kterou můžeme připravit reakcí dichromanu s kyselinou chlorovodíkovou. Tato reakce probíhá v přítomnosti kyseliny sírové jako dehydratačního činidla:[8]
K2Cr2O7 + 6 HCl → 2 CrO2Cl2 + 2 KCl + 3 H2O
nebo oxidu chromového s bezvodým chlorovodíkem:
CrO3 + 2 HCl → CrO2Cl2 + H2O
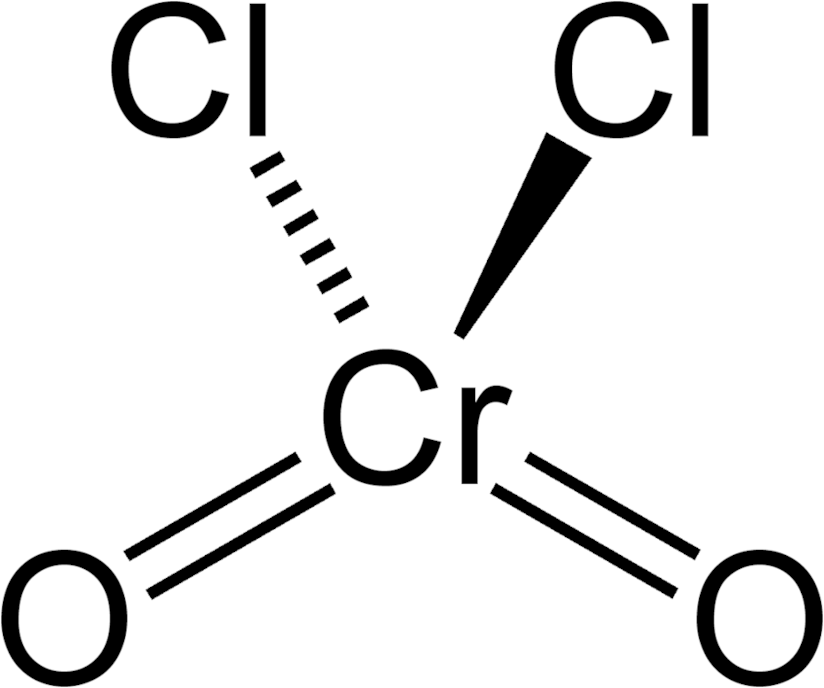

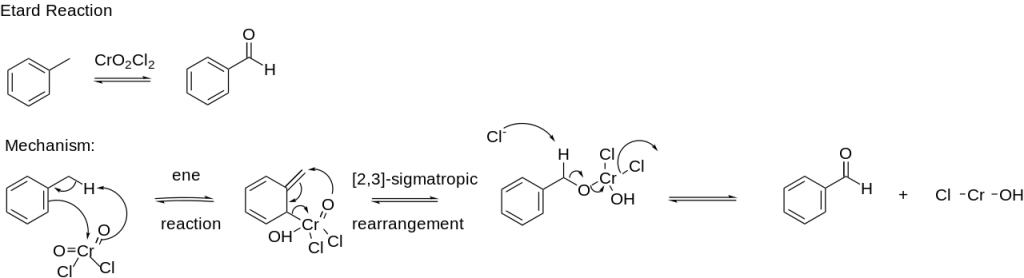
Je to taky silné oxidační činidlo, dokáže např. oxidovat toluen na benzaldehyd, tato reakce se označuje jako Étardova reakce:
Čtverná vazba
U chromu se setkáváme i s vyššími vazebnými řády. Příkladem sloučeniny se čtvernou vazbou je octan chromnatý. Jedna vazba je typu σ, dvě π a poslední vazba vzniká překryvem všech čtyř laloků d-orbitalů, označuje se jako δ (delta).
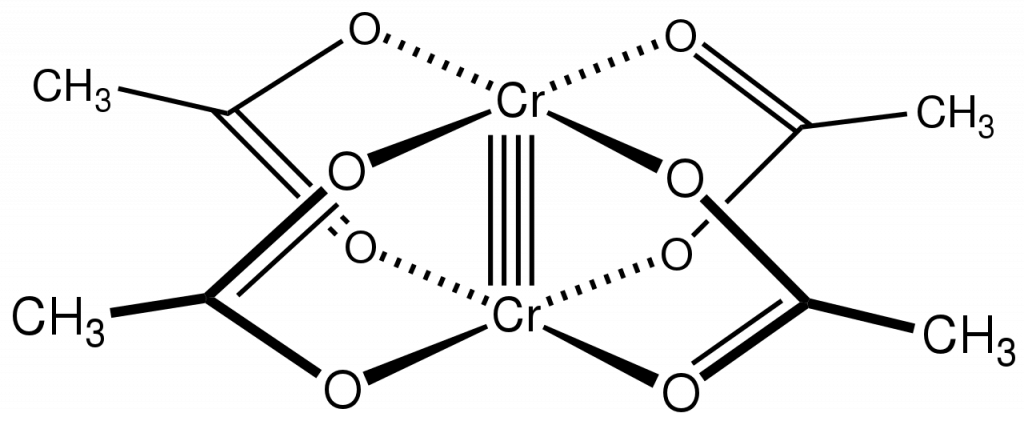
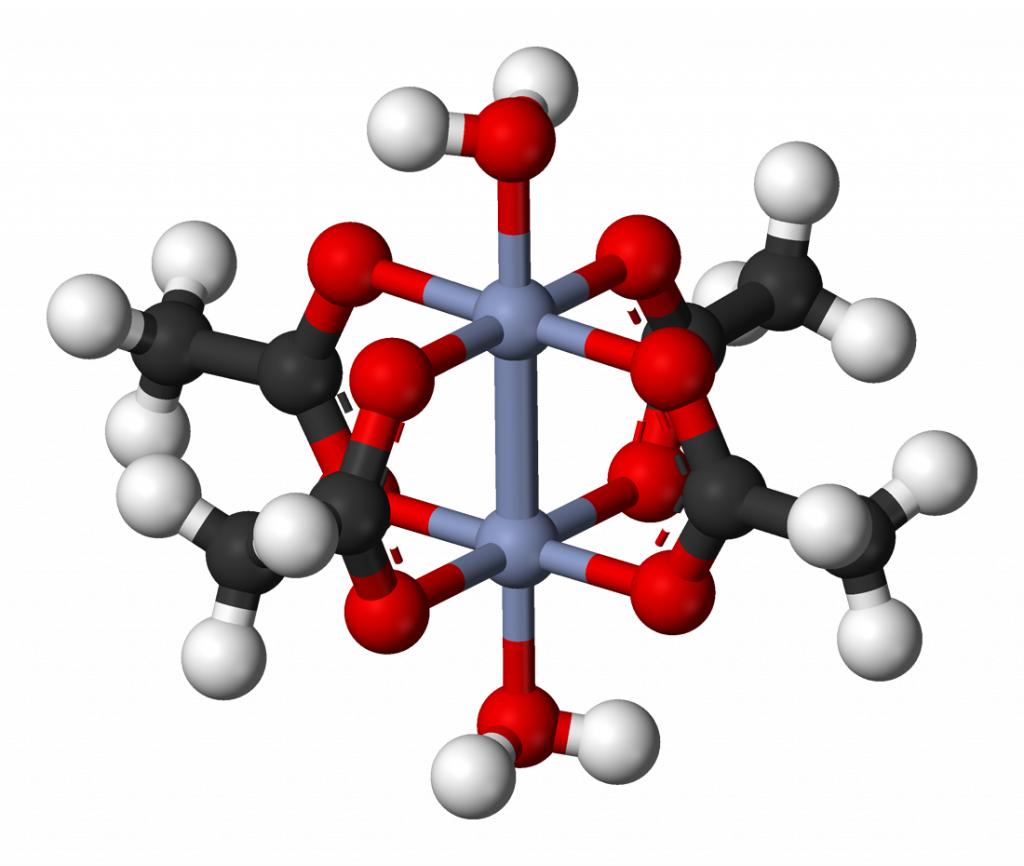
Lze jej připravit redukcí chloridu chromitého zinkem a následným srážením chromnatých iontů octanem:[4]
2 CrCl3 + Zn → 2 CrCl2 + ZnCl2
2 CrCl2 + 4 NaOAc + 2 H2O → Cr2(OAc)4(H2O)2 + 4 NaCl
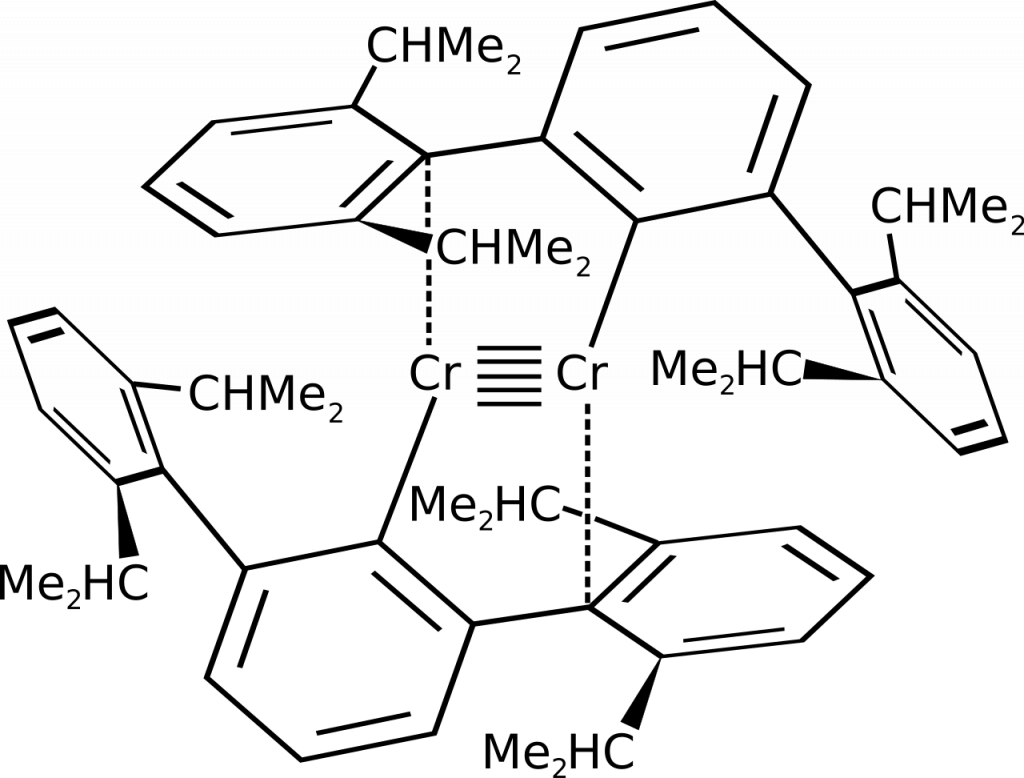
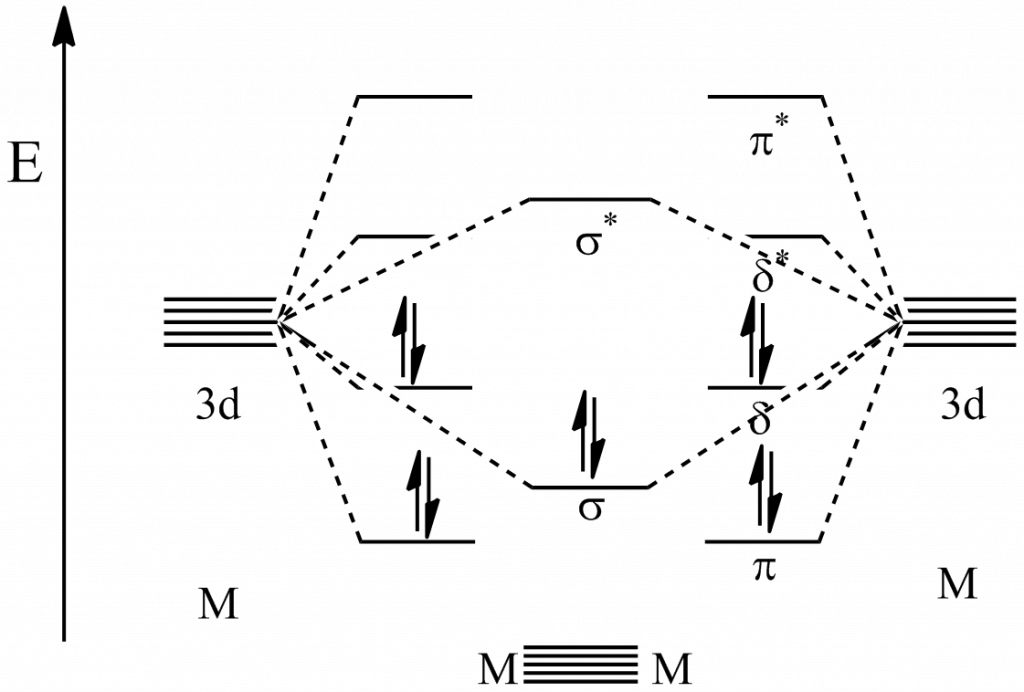
Paterná vazba
Tento typ vazby byl poprvé posán v roce 2005 u sloučeniny chromu připravené redukcí dimerní sloučeniny pomocí draselného interkalátu grafitu. Pro stabilizaci této vazby je nutné použít objemný ligand, např. (2,6-[(2,6-diisopropyl)fenyl]fenyl).[5]
NMR
Chrom má jeden NMR aktivní izotop – 53Cr. Je to kvadrupolární jádro s nízkou citlivostí. Standardem je nasycený roztok chromanu draselného (K2CrO4) v D2O.[9]
| 53Cr | |
| Spin | 3/2 |
| Zastoupení v přírodě [%] | 9,501 % |
| Citlivost vzhledem k 1H | 8,63×10-5 |
| Citlivost vzhledem k 13C | 0,507 |
| Rozsah chemických posunů | -1795 – 0 ppm |
| Rezonanční frekvence v poli 1 T | 2,4115 |
| Jaderný magnetický moment | -0,47454 |
Odkazy
- Chrom na české wikipedii
- Chrom na anglické wikipedii
- 53Cr NMR
- Anyhdrous Chromium(II) Acetate, Chromium(II) Acetate 1-Hydrate, and Bis(2,4-Pentanedionato)Chromium (II)
- ‚Quintuple‘ Bond Makes Its Debut
- Pure Chromyl Fluoride
- The chemistry of chromyl fluoride III. Reactions with inorganic systems
- Chromyl Chloride [Chromium(VI) Dioxychloride]
- (53Cr) Chromium NMR
- HÁLA, Jiří. Radioaktivní izotopy. Tišnov: Sursum, 2013. ISBN 978-80-7323-248-1. S. 94-97
Navigace
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| H | He | ||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr |
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe |
| Cs | Ba | La | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| Fr | Ra | Ac | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |
| Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu |
| Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr |
One Reply to “Chrom”